
【题目】![]() 是初中常见的7种物质,它们有如图所示的转化关系.已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰.
是初中常见的7种物质,它们有如图所示的转化关系.已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰.
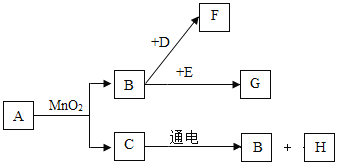
![]() 请写出下列物质的化学式:D______,G______,H______.
请写出下列物质的化学式:D______,G______,H______.
![]() 请写出下列变化的化学式表达式:
请写出下列变化的化学式表达式:
①![]() ______,
______,
②![]() ______,
______,
③![]() ______.
______.
【答案】C SO2 H2 2H2O2![]() 2H2O+O2↑ C+O2
2H2O+O2↑ C+O2![]() CO2 2H2O
CO2 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
A~G是初中常见的7种物质,A、C是无色液体,B、F、G是无色气体,大量F排放到空气中会引起温室效应,所以F为二氧化碳,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰,由于碳是一种黑色固体,在氧气中燃烧生成二氧化碳,硫在氧气中燃烧发出明亮的蓝紫色火焰,所以D为碳,E为硫,B为氧气,G为二氧化硫;过氧化氢在二氧化锰的催化作用下生成水和氧气,水通电分解生成氢气和氧气,所以A为过氧化氢,C为水,H为氢气,经过验证,推导正确。
(1)由分析可得, D为碳单质,其化学式为C;G为二氧化硫,其化学式为SO2;H是氢气,其化学式为H2;故填:C;SO2;H2。
(2)①A→B,即过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑。故填:2H2O2
2H2O+O2↑。故填:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
②B→F,即碳在氧气中燃烧生成二氧化碳,反应的化学方程式为:C+O2![]() CO2。故填:C+O2
CO2。故填:C+O2![]() CO2。
CO2。
③C→B,即水在通电情况下分解生成氧气和氢气,反应的化学方程式为:2H2O![]() 2H2↑+O2↑。故填:2H2O
2H2↑+O2↑。故填:2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:初中化学 来源: 题型:
【题目】某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
(工艺流程及原理)
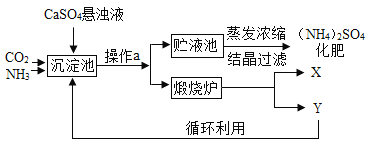
沉淀池中发生的主要化学反应为:CO2+2NH3+CaSO4+H2O=CaCO3↓+(NH4)2SO4
(讨论交流)
(1)操作a的名称是______,若在实验室进行此操作,用到的玻璃仪器除玻璃棒、烧杯外,还需要______。
(2)经操作a后得到的固体物质在煅烧炉中高温分解生成X和Y两种物质,该工艺中,Y被作为原料之一循环利用.Y的化学式为______。
(3)沉淀池中也可能生成少量NH4HCO3,该反应的化学方程式为______。
(硫酸铵化肥等级测定)
(1)判断(NH4)2SO4化肥中有无NH4HCO3:取少量试样溶于水,滴加足量的______,无气泡产生,则可判断该化肥中不存在NH4HCO3。
(2)化肥中氮元素含量的测定(已确定该化肥中不存在NH4HCO3杂质):
(查阅资料)
①已知:![]() ,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
,氨气极易溶于水,其水溶液为氨水.氨水呈碱性,不稳定,易挥发.
②工业判断硫酸铵化肥等级指标如下:
指标 项目 | 优等品 | 合格品 |
氮(N)含量 | ≥21.0% | ≥20.5% |
(实验设计)
按图所示装置进行实验.
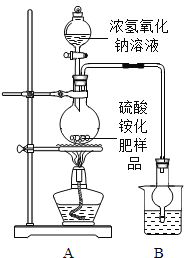
(1)实验过程中,往烧瓶中加入足量浓氢氧化钠溶液,并加热使硫酸铵充分反应完全转化为NH3.
(2)烧杯中的试剂是为了吸收产生的氨气,下列最适宜的试剂是______(填序号);
①水;②浓HCl;③稀H2SO4;④NaOH溶液
烧杯中干燥管的作用是______。
(交流讨论)
实验小组的同学认为,用上述实验装置测得的结果可能会出现下列情况.
(1)甲同学认为:应在实验装置A、B之间增加一个装有______(填“浓硫酸“或“碱石灰”)的干燥装置,否则实验测得的硫酸铵化肥含氮量可能偏高.
(2)乙同学认为:在实验装置A、B之间增加正确的干燥装置后进行实验,测得的硫酸铵化肥含氮量可能偏低,理由是______。
(实验测定)
经讨论后,他们改进了实验装置,排除了可能产生误差的因素,重新进行实验。取硫酸铵化肥样品13.5 g进行实验,测得B装置增重与反应时间的关系如图所示.请通过计算判断该化肥的等级.计算过程:_____;该化肥的等级为______品。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%, 含Fe2O3、CuO、SiO2等约30%)生产大颗粒-氧化钇的一种工艺如下:
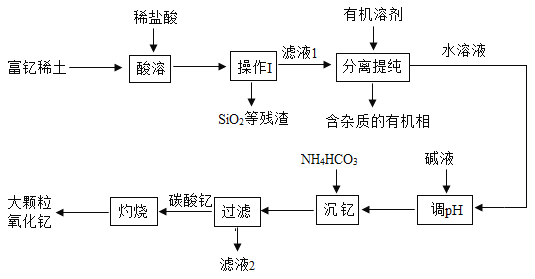
(1)操作I的名称是_____。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______。
(3)“分离提纯”是为了除去滤液1中的_____(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_____,此反应属于基本反应类型中的_____反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定某H2SO4溶液的溶质质量分数,现取200g硫酸溶液置于烧杯中,不断加入一定质量分数的BaCl2溶液,反应过程中杯中溶液的质量与加入BaCl2溶液的质量关系如图所示。请回答:

(1)反应生成沉淀的质量为_____g;在Q点时溶液中的离子为_____(用符号)。
(2)在反应过程中,杯中溶液的pH_____(填“变大”、“不变”或“变小”)。
(3)原硫酸溶液的溶质质量分数是多少_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下列实验操作可完成两个实验。请从A或B 两题中任选一个作答,若两题均作答,按A 计分。
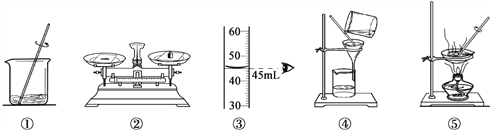
A去除粗盐中难溶性杂质 | B配制50g 10%的氯化钠溶液 |
(1)实验的操作步骤是___________(填序号)。 (2)实验中发现滤液浑浊,其原因是_____。 a.滤纸未贴紧漏斗内壁 b.滤纸破损 | (1)实验的操作步骤是____________(填序号)。 (2)实验后测得溶质质量分数<10%,其原因是_____。 a.装瓶时溶液洒出 b.烧杯中有水 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是

A. 甲和丙的溶解度相等
B. 在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g
C. 将t2℃时,甲的饱和溶液降温到t1℃,有晶体析出
D. 将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>Z>丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类; ②溶剂的种类;③溶质最多被溶解的质量; ④溶剂的质量; ⑤温度。
如测定“某物质在不同温度下的溶解度”,研究的是_________ (填序号)受温度的影响,这就需要控制其他因素保持不变。
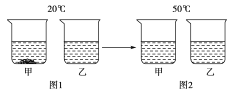
(2)右表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
温度(℃) | 20 | 40 | 50 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 |
KNO3 | 31.6 | 63.9 | 85.5 | |
①从上表可知,两种物质的溶解度受温度变化影响较大的是____________;
②20℃时,将等质量的NaCl、KNO3分别放入盛有100 g水的两个烧杯中,充分溶解后如图1所示,升温到50℃时如图2所示。试判断:50℃时甲烧杯中的溶液一定是______(填“饱和溶液”、“不饱和溶液”或“不能确定”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氢气 |
解释 | 集气瓶中的水:吸收放出的热 | 量简中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察H2何时收集满 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属与人类生活密切相关。请分析回答下列问题:
(1)将黄铜片和纯铜片相互刻画,发现纯铜片表面留下较深的划痕,则它们的硬度大小关系是:黄铜____纯铜(填“>”“<”或"=”);
(2)工业用赤铁矿石炼铁的反应原理是:![]() ,该反应中体现了CO具有______性;为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与10g样品充分反应(杂质不能反应),若反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式_________(用m表示).
,该反应中体现了CO具有______性;为测定某赤铁矿石中氧化铁的质量分数,用足量的一氧化碳与10g样品充分反应(杂质不能反应),若反应后剩余固体质量为m克,写出计算该赤铁矿石中氧化铁质量分数的表达式_________(用m表示).
(3)往![]() 溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中可能含有的金属离子是______(写离子符号),滤渣中一定含有的金属是________(写金属名称),
溶液中加入一定量锌和铜的混合粉末,充分反应后,过滤,滤液为蓝色,则滤液中可能含有的金属离子是______(写离子符号),滤渣中一定含有的金属是________(写金属名称),
(4)稀土元素铕是激光和原子能应用的重要材料。已知三氯化铕的化学式为![]() ,则氧化铕的化学式为__________。
,则氧化铕的化学式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com