
【题目】甲醇有酒的气味,有毒,饮后会使人双眼失明,甚至死亡,绝对禁止用含有甲醇的工业酒精兑酒饮用。下图是甲醇燃烧的微观模型图。
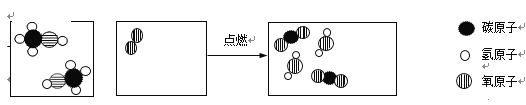
(1)甲醇的化学式为_____________。
(2)请把上图中的微观粒子补画完整________________。
(3)写出上述反应的化学方程式_____________________。
科目:初中化学 来源: 题型:
【题目】图甲是某实验小组设计的一个探究分子运动的实验,实验室会闻到一股难闻的氨气(NH3)臭味,于是他们重新设计了如图乙所示的实验装置。

实验操作:
①向盛有20mL蒸馏水的烧杯中滴入3~4滴无色酚酞溶液,搅拌均匀,观察溶液颜色。
②取少量上述溶液于试管中,向其中缓慢滴加浓氨水,观察现象。
③在E、F试管内分别倒入2mL操作①烧杯中的酚酞溶液(烧杯中剩余的酚酞溶液用于实验中作比较)。然后在空烧杯中倒入适量的热水备用。另在D、G试管中分别倒入2mL浓氨水,立即用带橡胶塞的导管按图乙连接好,并将G试管放置在热水中,打开铁丝夹,观察几分钟。请回答:
(1)按图甲装置实验容易闻到刺激性气味,说明分子____________________。
(2)操作③中图乙,烧杯中放热水的目的是___________,实验时可观察到E、F试管中的实验现象分别是E:___________、F:_____________。
(3)对比E、F试管中的实验现象还可以得到的一个新结论是温度越____________,分子运动速率____________。为了使新结论更可靠,在实验时需要注意控制的条件是__________________(写一条)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲乙两种固体物质的溶解度曲线。下列说法中,错误的是()

A.t2℃时,甲物质的饱和溶液中溶质质量分数为 30%
B.t1℃时,甲、乙两种物质的饱和溶液中溶质质量分数相等
C.可用降温的方法使甲物质的不饱和溶液变为饱和溶液
D.甲物质的溶解度受温度影响变化比乙物质大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用所学化学知识解答下列问题。
(1)常食用黑木耳可补充人体所需的铁元素,铁元素摄入不足可能会患_____症。
(2)打开汽水瓶盖,有气泡冒出,说明气体溶解度随压强减小而_____。
(3)钨可制作白炽灯泡的灯丝,原因是钨_____(写一条物理性质)。
(4)工业生产中常用环保高效的新型消毒剂ClxOy(相对分子质量小于130)进行消毒。该物质中氯元素和氧元素的质量比为71︰64,则该消毒剂的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】精制碘盐是食盐中添加一定量的碘酸钾,由于碘盐中碘含量相对较低,根本起不到预防放射性碘的作用。医疗专家提醒:不可盲目过量吃碘盐或碘片,过多摄入碘可诱发甲状腺亢进。则回答下列问题:
(1)碘盐中的“碘”指的是_____(选“分子”“原子”或“元素”),碘元素被誉为“智力之花”,是人体内合成_____的主要原料,如果人体内的碘元素缺少或含量过多会导致甲状腺亢进的症状。生活中若要预防甲状腺肿大,应该如何经常健康膳食_____。
(2)精制碘盐的储存方法是密封储藏和防潮湿,食用方法是待食物烹调好后再放入,可以准确推测碘酸钾的化学性质为_____。因此碘盐存放的科学方法是_____。
(3)世界卫生组织提示要求谨慎服用碘片,以减少人体甲状腺吸收放射性碘。推荐服用量为100毫克碘元素,每500g“云鹤”加碘食盐,经化验其中含有碘元素50mg,我们每天食用10g碘盐,则我们从碘盐中可吸收_____g碘元素,食用碘盐_____(能否)防治核辐射。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶没有密封好的氢氧化钠固体,为了验证其是否变质,同学们对这瓶固体成分进行了下列实验探究。
(查阅资料)Na2CO3溶液呈碱性,CaCl2溶液呈中性
(提出猜想)
猜想Ⅰ:固体全部是NaOH;
猜想Ⅱ:固体全部是______________;
猜想Ⅲ:固体是NaOH和Na2CO3的混合物。
(进行实验):
实验操作步骤 | 实验现象 | 结论及化学方程式 |
步骤1:取少量固体于试管中,加水溶解,滴入足量稀盐酸 | ______________ | 猜想Ⅰ不成立。 |
步骤2:另取少量固体于试管中,加水充分溶解,再滴加过量氯化钙溶液 | ______________ | 猜想Ⅱ或Ⅲ成立。 反应的化学方程式为: _______________________________ |
步骤3:取步骤2反应后的上层清液于试管中,滴入无色酚酞试液 | 若酚酞不变红色 | 猜想________成立 |
若酚酞变红色 | 猜想________成立 |
(问题讨论)步骤2中滴加氯化钙溶液必须“过量”的原因是________________。
(反思与交流)久置的固体氢氧化钠变质的原因是(用化学方程式表示)______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】数型图象是研究化学问题的一种常见描述方法,根据下列图象进行回答:
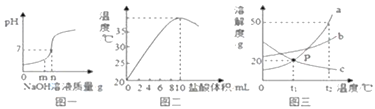
(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线.向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为__________(填离子符号);
(2)图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系.
①由图可知中和反应是放热反应,你的依据为__________;
②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为__________;
(3)图三是a、b、c三种物质的溶解度曲线.a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用_________的方法达到饱和状态;
②将t2℃时,150ga物质的饱和溶液降温到t1℃时,可以析出______物质.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示.则有关说法中不正确的( )

A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为8: 1
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
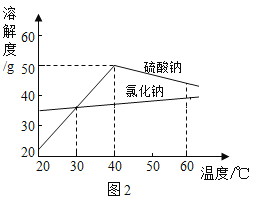
【题目】Na2SO4是制造纸张药品染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2,实验室提纯Na2SO4的流程如图1所示。

(1)加入NaOH溶液可除去的阳离子是_____(填离子符号)。若添加的NaOH溶液和Na2CO3溶液过量,可加入适量_____(填名称)除去。
(2)溶液M中的溶质是Na2SO4和杂质NaCl,观察图2的溶解度曲线,则操作b是:先将溶液M蒸发浓缩,再降温结晶过滤。降温结晶的最佳温度范围是_____℃以下,因为Na2SO4的溶解度_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com