
【题目】化学是研究物质的组成、性质以及变化规律的科学。化学学习过程要关注物质的性质以及能发生哪些变化和发生变化过程中的现象。现有A、B、C三种物质,它们可能是O2、Fe、H2O、H2O2、CaO、Fe2O3、HCl、NaOH、Ca(OH)2、Na2CO3中的—种。
(1)若A、B是由相同元素组成的化合物,且B分解能产生A和C。请写出该化学反应方程式______。
(2)若A、B中含有相同的金属元素,并均可与C的溶液反应,生成金属元素化合价不同的两种盐溶液。则C的化学式是______;请写出能产生黄色溶液的化学反应方程式______。
(3)若A、B、C是三种不同类别的物质,分别属于酸、碱和盐,将它们依次加入同一个烧杯中:
① 若均无明显现象,则A、B、C分别是______ (填化学式);
② 若能产生白色沉淀,请写出酸、碱中和的化学反应方程式______。
【答案】(1)2H2O2![]() 2H2O+O2↑;(2)HCl;Fe2O3+6HCl=2FeCl3+3H2O
2H2O+O2↑;(2)HCl;Fe2O3+6HCl=2FeCl3+3H2O
(3)①HCl、NaOH、Na2CO3;②Ca(OH)2+2HCl=CaCl2+2H2O;
【解析】(1)A、B是由相同元素组成的化合物,且B分解能产生A和C,则B是H2O2,A是H2O,C是O2,反应的化学方程式为2H2O2![]() 2H2O+O2↑(2)若A、B中含有相同的金属元素,并均可与C的溶液反应,生成金属元素化合价不同的两种盐溶液,则A、B是Fe、Fe2O3,两种物质都能与盐酸反应,。故C的化学式是HCl,Fe3+所形成的溶液是黄色,能产生黄色溶液的化学反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O(3)① HCl与NaOH反应无现象,NaOH与Na2CO3不反应,无现象,故A、B、C分别是HCl、NaOH、Na2CO3②若能产生白色沉淀,则是Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH,故酸、碱反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
2H2O+O2↑(2)若A、B中含有相同的金属元素,并均可与C的溶液反应,生成金属元素化合价不同的两种盐溶液,则A、B是Fe、Fe2O3,两种物质都能与盐酸反应,。故C的化学式是HCl,Fe3+所形成的溶液是黄色,能产生黄色溶液的化学反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O(3)① HCl与NaOH反应无现象,NaOH与Na2CO3不反应,无现象,故A、B、C分别是HCl、NaOH、Na2CO3②若能产生白色沉淀,则是Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH,故酸、碱反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O


科目:初中化学 来源: 题型:
【题目】读识下面几种常见元素的原子结构示意图,请写出一种符合要求物质的化学式:

(1)只含有一种元素 ;(2)含有二种元素 ;
(3)含有三种元素 ;(4)含有四种元素 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示.则有关说法中不正确的( )

A.丁一定是化合物
B.乙可能是这个反应的催化剂
C.生成的甲、丙两物质的质量比为8: 1
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】焦亚硫酸钠在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠(Na2S2O6)中硫元素的化合价为
A. -2 B. +3 C. +4 D. +5
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用符合要求的物质的序号填空。
①生石灰 ②盐酸 ③石墨 ④碘酒
(1)可用于伤口消毒的是 。
(2)可用于制作铅笔芯的是 。
(3)可用作食品干燥剂的是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2017年1月27日,南京理工大学化学学院胡炳成团队成功合成世界上首个超高能全氨阴离子(N5-)钴(Co)盐【化学式为:Co(N5)2(H2O)4】。下列有关说法正确的是
A.该物质属于混合物 B.该物质中钻元素的质量分数比氧元素的质量分数小
C.该物质中钴元素的化台价为+5价 D.该物质属于有机物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一部分被氧化成氧化镁的镁粉样品、未知浓度盐酸和40%的氢氧化钠溶液。兴趣小组同学为分析样品中金属镁的质量百分含量和计算盐酸的质量分株,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量。实验数据如下表所示:
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
镁粉样品中金属镁的质量百分含量为_________________。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)
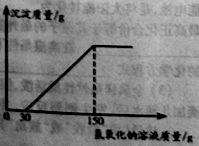
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶由氯化钾和硝酸钾组成的化肥,但标注的质量分数己模糊不清,小明想通过实验重新标注,以下是他进行的实验步骤:
①取10克样品于烧杯中,加入蒸馏水充分溶解,配制成60克溶液;
②在配制的溶液中,加入一定量的硝酸银溶液,恰好完全反应;
⑧将上述混合液过滤,沉淀经洗涤、干燥后,称得质量为14.35克。
请根据上述实验回答:(相关反应的化学方程式为:KCl+AgNO3=AgCl↓+KNO3)
(1)在过滤操作中使用的玻璃仪器有:烧杯、______和玻璃棒。
(2)样品中氯化钾的质量分数为多少?(要求列式计算)
(3)完全反应后,混合液中的硝酸钾质量是多少克?
(4)为了回收硝酸钾,小明对滤液进行蒸发、结晶、称量,发现所得的晶体质量小于计算得出的理论值。造成这种结果的原因可能是 ______。 (选填编号)
A.晶体没有干燥 B.蒸发时液体飞溅 C.硝酸钾残留在玻璃棒上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com