
构建知识框架是学习科学的重要方法,如图是初中科学金属的冶炼框架图(反应条件已省去)。已知甲、丁是最常见的固体金属,乙是常见的非金属固体,“→”表示反应的方向,请回答下列问题:
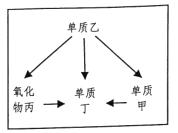
(1)单质乙是______;
(2)“单质甲→单质丁”表示湿法炼铜,请写出其化学方程式______;
(3)在冶炼金属丁的过程中,乙、丙的共同性质是______。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源:河南省鹿邑县2019-2020学年九年级上学期期中化学试卷 题型:填空题
将下列灭火时采取措施的原理填在横线上。
(1)家里煤气起火时,应先关闭阀门_____;
(2)油锅着火,用锅盖盖灭_____;
(3)用嘴吹灭蜡烛_____。
查看答案和解析>>
科目:初中化学 来源:上海市嘉定区2019-2020学年九年级上学期期末(一模)化学试卷 题型:实验题
请结合下列实验装置,回答问题:
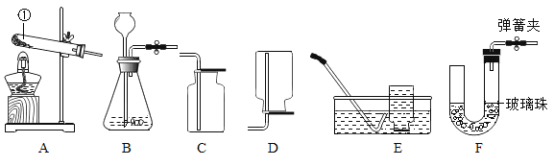
(1)仪器①的名称是_____。
(2)若用 A 装置制氧气,完全反应后,试管中剩余的固体药品是_____。
(3)实验室用双氧水制氧气的发生装置应选择_____装置(填上图装置字母),化学方程式为:_____。研究显示O2的体积分数大于 36%时可使带火星的木条复燃,因此,氧气验满时采用带火星的木条复燃的方法_____(填“可靠”或“不可靠”),为了收集一瓶较纯净的氧气最好选择_____装置(填上图装置字母)。
(4)图 F 所示的装置可以替代启普发生器制取二氧化碳。
I、该装置右侧放的药品是_____,左侧放的药品是_____。
II、使用该装置制取气体应满足的条件是_____。
III、请简述使该装置中反应停止的原理:_____。
(5)实验室用 100g 的大理石与足量的稀盐酸制取二氧化碳,充分反应后生成 0.5mol 二氧化碳气体,请问参加反应的碳酸钙质量为多少克?_____(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源:上海市嘉定区2019-2020学年九年级上学期期末(一模)化学试卷 题型:单选题
空气中体积分数约为78%的物质是
A. O2 B. N2 C. CO2 D. H2O
查看答案和解析>>
科目:初中化学 来源:天津市红桥区2019-2020学年九年级上学期期末化学试卷 题型:填空题
随着经济的发展,能源与环境成为人们日益关注的问题.
(1)煤、_____、_____常称为化石燃料.
(2)燃煤发电时,将煤块粉碎成煤粉,其目的是_____.
(3)化石燃料燃烧都会产生二氧化碳,它是空气中含量最多的温室气体.为减少它的排放,科学家致力于研究将过多的二氧化碳和氢气在催化剂和加热的条件下反应,转化为水和甲烷.该反应的化学方程式为_____.
(4)“绿色化学”的特点之一是“零排放”.一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物.其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,这种产物是_____(填字母序号).
A 甲醇CH4O B 甲酸CH2O2 C 乙醇C2H6O D 乙酸C2H4O2
查看答案和解析>>
科目:初中化学 来源:天津市红桥区2019-2020学年九年级上学期期末化学试卷 题型:单选题
如图表示对一杯氯化钠溶液进行恒温蒸发的过程,丙、丁溶液中析出部分氯化钠固体。下列说法错误的是( )
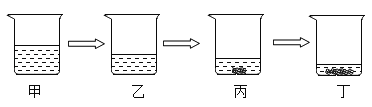
A.甲溶液一定是不饱和溶液
B.甲、乙两杯溶液中的溶质质量一定相等
C.整个实验过程中氯化钠的溶解度保持不变
D.烧杯中溶液的溶质质量分数大小关系为:丁>丙>乙>甲
查看答案和解析>>
科目:初中化学 来源:湖南省长沙市集团2019-2020学年九年级上学期第三次月考化学试卷 题型:填空题
写出下列变化的化学方程式:
(1)二氧化碳使澄清石灰水变浑浊:_____;
(2)金属钯是稀有的贵金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住岁月的磨砺。如果将钯粉(Pd)置于盐酸溶液中,边通入氧气边搅拌,生成二氯化钯(PdCl2)和水。请写出该反应的化学方程式::_____。
查看答案和解析>>
科目:初中化学 来源:江苏省扬州市2019-2020学年九年级上学期12月月考化学试卷 题型:科学探究题
电影《我和我的祖国》中有这样一则片段:开国大典前夜, 升旗试验出了问题,旗杆顶部的阻断球因锈蚀变脆而折断,为保证当天升 旗成功,采用焊接方式换上新的不锈钢阻断球,最终升旗仪式完美无缺。

(一)阻断球是常见的铁制品,工业上常用设备高炉来炼铁,主要原料是 焦炭、赤铁矿石(主要含 Fe2O3)、石灰石、空气等,主要反应过程如下:

请回答:
(1)将炼出的“铁”加足量盐酸,充分反应后,总有黑色物质剩余,该黑色物质为________填 化学式);
(2)反应②的化学方程式为_____,该反应所属的基本反应类型为_____。
(二)金属的锈蚀及防护
(1)铁质阻断球的生锈,实际上是铁与_______、_____________共同作用的结果。铁锈的颜色是______;下列情况下铁制品最易生锈的是______(填序号).
a 潮湿空气中 b 干燥空气中 c 部分浸入食盐水中
(2)生活中的铁制品琳琅满目,铁还可以作铁锅利用了铁的_______性,请写出一种生活中防止铁锅生锈的方法:_______。
(3)金属铝比铁活泼,却具有很好的抗腐蚀性,原因是_____________ (用方程式表示)
(三)铁锈组成分析测定
(查阅资料)铁锈成分复杂,化学式可简单表示为 Fe2O3•nH2O,在加热时会分步反应,首 先失去结晶水,其反应可表示为 Fe2O3•nH2O Fe2O3+nH2O。浓硫酸可以吸水,碱石灰 可以吸收水和二氧化碳。
Fe2O3+nH2O。浓硫酸可以吸水,碱石灰 可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3•nH2O)中 n 的值等于多少呢?
(问题探究)为了探究铁锈(Fe2O3•nH2O)的组成,称取 30.0g 部分生锈的铁粉样品,样品中仅含铁和 Fe2O3•nH2O,按如图 2 所示装置进行实验。

(1)为了保证实验安全,实验开始时应先通 CO,目的是_______;
(2)反应结束后还需持续通 CO,除了防止铁氧化以外,还有_______ 的目的。
(3)实验结束后,A 中玻璃管内出现的现象是_______ ;
(4)请指出该装置中有一处明显不足_______ ;
(数据处理)图 3 是加热时间和 A 中固体质量关系图象,下表是 B、C 中质量不再变化时 B中浓硫酸、C 中碱石灰装置质量变化情况。

反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150.0 | 163.2 |
(5)完全反应产生的二氧化碳质量为_______ ;铁锈(Fe2O3•nH2O)中 n 的值是______;
(6)写出 T3-T4 时间段所发生的化学方程式_______
(7)计算 30g 样品中单质铁的质量分数_______。(写出计算过程,结果保留到 0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com