(2011?茂名)碱式氯化铝是某种高效净水剂的主要成分.实验室利用铝土矿(主要含Al
2O
3,还含少量Fe
2O
3及其他不溶杂质)制取碱式氯化铝的过程如下:
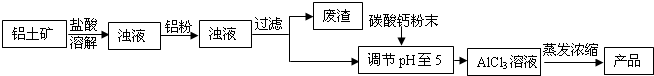
(1)溶解过程中,需要使用质量分数为15%的盐酸,则配制这种盐酸需要
100
100
mL,30%的浓盐酸(密度约为1.15g/cm
3)和115g蒸馏水.
(2)盐酸溶解铝土矿过程中,发生反应的化学方程式为
Al2O3+6HCl=2AlCl3+3H2O;Fe2O3+6HCl=2FeCl3+3H2O
Al2O3+6HCl=2AlCl3+3H2O;Fe2O3+6HCl=2FeCl3+3H2O
.
(3)加少量铝粉的主要作用是:除去浊液中的
铁离子(Fe3+)
铁离子(Fe3+)
.
(4)加CaCO
3粉末的作用是调节pH至5.请写出用pH试纸测定溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,
将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
将被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较
,得出被测液的pH.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案