
【题目】请沿用科学家认识事物的方式认识“空气”。
(1)从空气组成角度:某同学利用红磷测定空气中氧气的含量,实验装置如图所示。

①实验原理:______(用化学方程式表示)。
②实验步骤:先用弹簧夹夹住橡皮管,点燃红磷,伸入瓶中并塞上瓶塞。等红磷燃烧熄灭后再打开弹簧夹。
③误差分析:发现实验结论大于理论值,可能的原因有______。
A.装置漏气
B.实验时使用的红磷过量
C.实验时插入燃烧匙的速度太慢,集气瓶内部分空气受热逸出
D.红磷熄灭后没等集气瓶冷却就立刻打开弹簧夹
(2)从微观角度:用“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示氧原子。
”表示氧原子。
① 用“![]() ”可表示的微粒是______(填名称)。
”可表示的微粒是______(填名称)。
② 同温同压下,气体的体积比等于分子数目比。若空气中其它成分忽略不计,下图可表示空气微观模型的是______(填标号)。

(3)从变化角度:
已知:常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是______。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是______。
(4)从应用角度:利用空气制取氮肥的流程下图所示。

① Ⅰ中参加反应的单质甲为______。
② Ⅱ中反应的化学方程式为______。
③ 物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ______(填“属于”或“不属于”)氧化还原反应。
(5)从环保角度:下列保护空气措施合理的是______(填标号)。
A.工厂通过加高烟囱直接排放废气
B.推广使用乙醇汽油代替普通汽油
C.提倡步行、骑自行车等“低碳”出行方式
【答案】 4P + 5O2 点燃 2P2O5 C 氮气 C 木条熄灭 液氧 氢气 4NH3 + 5O2 催化剂、高温 4NO + 6H2O 属于 BC
【解析】根据所学知识和题中信息知,(1)从空气组成角度:某同学利用红磷测定空气中氧气的含量。①实验原理:4P + 5O2 ![]() 2P2O5 。②实验步骤:③误差分析:发现实验结论大于理论值,可能的原因有C.实验时插入燃烧匙的速度太慢,集气瓶内部分空气受热逸出。
2P2O5 。②实验步骤:③误差分析:发现实验结论大于理论值,可能的原因有C.实验时插入燃烧匙的速度太慢,集气瓶内部分空气受热逸出。
(2)从微观角度:① 用“![]() ”可表示的微粒是氮气。② 同温同压下,气体的体积比等于分子数目比。可表示空气微观模型的是C。(3)从变化角度:常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是木条熄灭,液体气化吸热 。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是液氧 。(4)从应用角度:利用空气制取氮肥。① Ⅰ中参加反应的单质甲为氢气,② Ⅱ中反应的化学方程式为4NH3 + 5O2
”可表示的微粒是氮气。② 同温同压下,气体的体积比等于分子数目比。可表示空气微观模型的是C。(3)从变化角度:常压下,氮气沸点-196℃,氧气沸点-183℃。将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是木条熄灭,液体气化吸热 。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是液氧 。(4)从应用角度:利用空气制取氮肥。① Ⅰ中参加反应的单质甲为氢气,② Ⅱ中反应的化学方程式为4NH3 + 5O2 ![]() 4NO + 6H2O。③ 物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ 属于氧化还原反应。(5)从环保角度:保护空气措施合理的是B.推广使用乙醇汽油代替普通汽油。C.提倡步行、骑自行车等“低碳”出行方式。
4NO + 6H2O。③ 物质所含元素化合价发生变化的反应称为氧化还原反应。反应Ⅲ 属于氧化还原反应。(5)从环保角度:保护空气措施合理的是B.推广使用乙醇汽油代替普通汽油。C.提倡步行、骑自行车等“低碳”出行方式。
点睛∶本题主要从微观,变化,应用,环保等方面考查空气组成和用途。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:初中化学 来源: 题型:
【题目】如图所示的是分解过氧化氢溶液制取氧气的实验。李明同学先在试管中加入了一部分过氧化氢溶液,然后将带火星的木条伸进试管中,发生的现象是___________________;他又向过氧化氢溶液中加入了适量的氧化铜粉末(可做此反应的催化剂),将带火星的木条伸进试管中,李明观察到的现象是_______________,请写出上述反应的化学反应方程式__________________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐是工业和生活中应用比较广泛的化学物。用你一年来所学的有关酸碱盐的知识回答下列问题:
(1)下列物质存放在烧杯中,一段时间后,质量变大且变质的是__________。
①浓盐酸 ②浓硫酸 ③烧碱 ④澄清石灰水 ⑤食盐
(2)把50g质量分数为98℅的浓硫酸稀释为20℅的硫酸用于下面的实验,需要水的质量是______。
(3)某化学兴趣小组的同学问一定量NaHCO3的溶液中加入一定量的稀H2SO4。待反应量是完全后(假设反应所产生的气体全部逸出),对反应后溶液中的溶质的成分进行如下探究:
[实验用品]pH试纸、Zn片、氧化铜粉末、稀H2SO4、NaOH溶液、BaC2l溶液.
[假设猜想]猜想一:Na2SO4;猜想二:Na2SO4、NaHCO3;猜想三:Na2SO4、H2SO4。
[实验探究]同学们取反应的溶液用不同方案进行如下实验,请根据现象或结论填空。
实验方案 | A | B | C | D |
操作 |
|
|
|
|
现象 | 无气泡产生 | 试纸变色,对照比色卡,pH<7 | ① _______ | 产生白色沉淀 |
结论 | ②______ | 猜想三正确 | 猜想三正确 | 猜想三正确 |
[得出结论]猜想三正确
[评价反思]老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在的两处明显错误,分别是:
③__________;④_________。
[总结提高]依据所级实验用品,你还有什么不同的方法确认猜想三是正确的,请写出你的实验方案。
⑤____________。
(4)胃酸过多的病人,通常需每天服用含碳酸钠的药物9片,能消耗胃酸中的氯化氢2.19g。某病人有胃溃疡病症,这种药物会加剧胃部疼痛,医生建议改用含氢氧化铝(其他成分不与胃酸反应)的胃舒平,药物标签如图所示。请计算中和相同质量的胃酸,每天需要服用胃舒平多少片?____________

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质,现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。
试求:(1)该纯碱样品的纯度(计算结果精确到0.1%)
(2)所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质(均不含结晶体)的溶解度曲线,根据图示,下列说法不正确的是
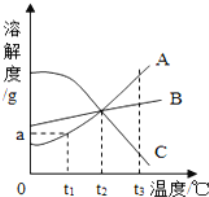
A. t2℃时,A、B、C种物质的溶解度相等
B. t1℃,将A、B、C各ag放入100g水中,充分搅拌,所得溶液溶质质量分数均相等
C. t3℃时,取A、B、C三种饱和溶液降温到t1℃,析出晶体最多的是A,没有晶体析出并变成不饱和溶液的是C
D. 从A与少量C的混合物中提纯A,可用降温结晶的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fex(OH)y(SO4)z]m。某中学化学兴趣小组以聚合硫酸铁的生产流程和相关性质进行了一系列的探究。
Ⅰ.聚合硫酸铁的工业生产。
如图是以回收废铁屑为原料制备PFS的一种工艺流程。
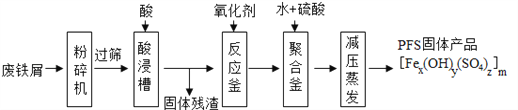
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为______。“过筛”与化学实验中的______原理相似(填操作名称)。
(2)酸浸时最合适的酸是______,写出铁锈与该酸反应的化学反应方程式______。
(3)反应釜中加入氧化剂的作用是将Fe2+转化为Fe3+。你认为下列氧化剂中最合适的是
______(填标号),原因是______。
A.KMnO4 B.Cl2 C.H2O2 D.HNO3
(4)相对于常压蒸发,减压蒸发的优点是______。
A.有利于水分蒸发 B.降低沸点,防止晶体分解 C.降低生产成本
Ⅱ.聚合硫酸铁的成分探究。
该研究小组为确定聚合硫酸铁的化学式,进行了如下实验:
①称取5.52 g聚合硫酸铁样品溶于足量的稀盐酸中并充分混合;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,得沉淀4.66 g。
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体3.20 g。
则聚合硫酸铁[Fex(OH)y(SO4)z]m样品中的x:y:z的值为______。
试写出该聚合硫酸铁与盐酸的反应方程式______。
Ⅲ.聚合硫酸铁的热分解气体产物成分探究。
该小组将5.52 g聚合硫酸铁在一定条件下加热完全分解,对所得气体产物进行实验探究。(已知SO3的熔点为16.8℃)。
【提出假设】
假设1:所得气体的成分是SO3;
假设2:所得气体的成分是SO2、O2;
假设3:所得气体的成分是______。
【设计实验】
按下图装置进行实验。
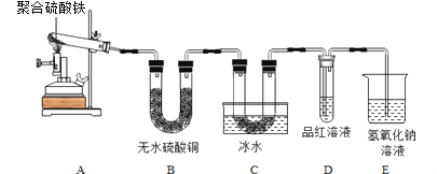
实验过程中发现:B中无水硫酸铜变蓝,C中U形管内有无色晶体析出,D中品红溶液褪色,装置E的作用是______。
【实验结论】
通过实验现象判断,假设______成立。
如果最终试管中固体为一种红棕色纯净物,则质量为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列能反映相关实验过程中量的变化的图象是
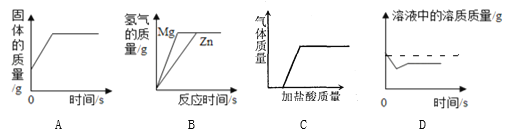
A. 用一氧化碳还原氧化铁
B. 等质量镁、锌分别和足量的稀盐酸反应
C. 向含少量Cu粉的铁粉中滴加稀盐酸至过量
D. 某温度时,向一定量的饱和氢氧化钙溶液中加入少量氧化钙,再恢复到原温度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为工业利用石灰石和食盐水制作漂白粉的流程图。

(1)石灰石高温燃烧得到的两种氧化物,反应的化学方程式为______________。
步骤Ⅰ涉及到的能的转化是__________________________________。
(2)请写出操作A用到的一种玻璃仪器的名称_________________,步骤Ⅲ得到的滤液中的溶质是____________________。
(3)漂白粉的主要成分是Cacl2和Ca(Cl0)2,其中Ca(Cl0)2中氯元素的化学价是_______。
(4)步骤Ⅴ采用低温蒸干,由此你推断出漂白粉的成分可能具有一定性是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列各组物质中少量的杂质,所用试剂或方法正确的是
选项 | 物质 | 杂质 | 除杂所用试剂或方法 |
A. | CO2 | CO | 点燃 |
B. | Ag粉 | Mg粉 | 适量稀硫酸 |
C. | NaOH溶液 | Na2CO3 | 适量稀盐酸 |
D. | NaCl | KNO3 | 冷却结晶 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com