
【题目】人类生活和工农业生产都离不开水,下图是自来水厂净化水的过程示意图:请根据图示回答下列问题:
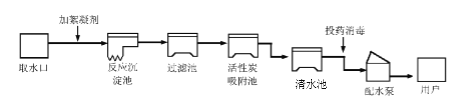
(1)自来水厂生产自来水时,使用的净水方法有_______(填序号);
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
(2)取水后加入絮凝剂(明矾)的作用是_______________________;
(3)自来水厂常用ClO2、漂白粉[有效成分为Ca(ClO)2]于饮用水消毒。工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O,X的化学式为_______ ;
(4)节约用水人人有责,请举出一种节水的措施_______。
科目:初中化学 来源: 题型:
【题目】硫酸锌可作为食品添加剂。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的FeO、CuO。工艺流程图如下:(假设每一步骤反应均完全)

⑴为提高矿石的溶解速度,操作1是___________ 。
⑵菱锌矿溶解后所得的溶液中金属阳离子有_____________种。
⑶反应1中H2O2转化为H2O,同时有Fe2(SO4)3生成,写出反应1中生成Fe2(SO4)3的化学方程式___________________________。
⑷结晶之前,溶液中除了硫酸锌,还一定存在的溶质是_________________。
⑸硫酸锌晶体的溶解度曲线如下图所示,若要获得ZnSO4·7H2O晶体,应控制结晶时的温度范围为____________________。

⑹流程中还可能得到一种紫罗兰色晶体(NH4)xFey(SO4)z·7H2O。已知该化合物中氮、铁元素质量比为1:4,则x:y :z=________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家发现,通过简单的化学反应,可以将树木的纤维素变成超级储能装置,下图是该反应的微观示意图,下列说法正确的是________
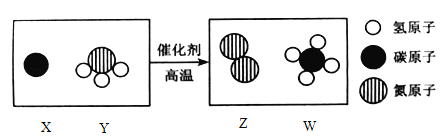
A.W物质中碳元素的质量分数为50%
B.化学反应前后原子的种类、个数、质量均保持不变
C.上图中涉及的化合物有3种
D.参加该反应中Z与W的分子个数比为__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们利用下图所示装置进行气体的制备实验(A~E为装置编号)。

(1)写出图中标示的仪器名称:①_______ 。
(2)实验室用高锰酸钾制取氧气的化学方程式为______,可选用的发生装置是_______。
(3)如果要收集氢气,则不能选择的收集装置是_______。
(4) 实验室选用B为发生装置制二氧化碳,如用分液漏斗替换仪器②,其优点是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液。生成沉淀的质量与所用氢氧化钠溶液的质量关系下图所示。已知:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓。
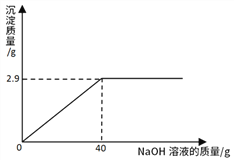
(1)配制40g溶质质量分数为10%的NaOH溶液,需NaOH的质量=_______g。
(2)计算MgSO4溶液中溶质的质量分数为________________(列式计算)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图中字母代表含硫元素的物质,下列判断错误的是
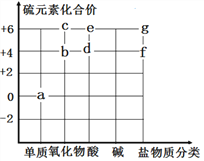
A. 物质d为H2SO3 ,读作亚硫酸
B. 物质b与氧气反应可生成物质C
C. 物质a在氧气中燃烧可以生成物质C
D. 物质Na2SO3、CaSO4可分别用f、g表示
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CaCO3在生产生活中有广泛的用途.
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________。为测定不同煅烧温度对CaO活性的影响,某化学兴趣小组进行了如下实验:
Ⅰ.取石灰石样品分为三等份,在同一设备中分别于800℃、900 ℃和1000℃条件下煅烧;
Ⅱ.所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。上述温度中,___________℃时煅烧所得CaO活性最高。
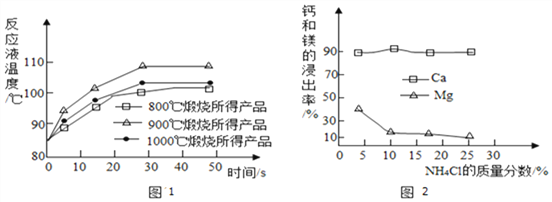
(2)以电石渣(主要成分为Ca(OH)2,还含有少量MgO等杂质)为原料制备高纯活性CaCO3的流程如图3。(资料:氨水的pH约为11.7,氢氧化镁完全沉淀的pH约为10.87)
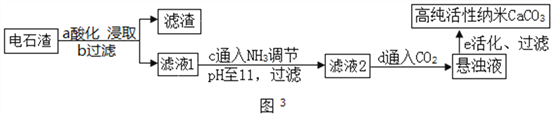
①步骤a中加入的药品为NH4Cl溶液,由此说明NH4Cl溶液呈________性(填酸性、中性或碱性);如图2为浓度对钙、镁元素浸出率的影响。由图可知NH4Cl溶液的质量分数达到10%以上主要溶解的是Ca(OH)2;浸取时主要发生反应的化学方程式为_________________。
②流程c通入NH3的目的主要有两个,一是调节溶液的pH值,二是_______。
③滤液1中通入NH3和CO2后生成碳酸钙和氯化铵,写出发生反应的化学方程式为________________。
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程中可循环利用的物质有__________________(写出两种物质)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列 4 个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
向一定量稀硫酸中加 入 NaOH 溶液 | 浓硫酸长期暴露在空 气中 | 向一定量的硫酸溶液 中逐滴滴入氢氧化钡 溶液至过量 | 相同条件下,加热质 量相等的两份固体,a 为氯酸钾和二氧化锰 的混合物,b 为氯酸 钾 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为海水吸收CO2并进行碳循环的原理示意图。回答下列问题:
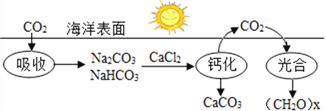
(1)“光合”作用中太阳能转化为_________。
(2)写出“钙化”中发生的两个反应的化学方程式:a.__________; b.__________。
(3)此循环过程中吸收的CO2与“钙化”中释放的CO2的质量关系是_________________(填“大于”、“小于”或“等于”)。
(4)此碳循环中将CO2转化为(CH2O)x属于_______(填“无机物”或“有机物”),同时生成的一种无机物是_______。此碳循环过程的优点是_______(写出一点即可)。
(5)工业上从海水中可提取许多广泛应用于生活、生产、科技等方面的物质和原料。
Ⅰ.从海水中获得淡水。下列方法常用于海水淡化的是_________(填字母)。
A.蒸馏法 B.吸附法 C.沉淀法 D.过滤法
Ⅱ.从海水中提取溴(Br2)。工业上通常是将氯气通入海水晒盐后的母液中,将溶液中的溴化钠(NaBr)转化为溴单质(Br2),然后鼓入热空气,使溴单质(Br2)从溶液中挥发出来,冷凝后得到粗溴。其中主要反应的化学方程式为______,其基本反应类型是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com