
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示,则有关说法中不正确的是( )

A. 丁一定是化合物
B. 参加反应的丁的质量一定等于生成甲和丙的质量之和
C. 生成的甲、丙两物质的质量比为8:1
D. 乙可能是这个反应的催化剂
【答案】C
【解析】
由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数增加了19%﹣17%=2%,故甲是生成物;乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应;反应后丙的质量分数增加了41%﹣25%=16%,故是生成物;丁的质量分数减少了48%﹣30%=18%,丙是反应物。
A、该反应的生成物为甲和丙,反应物是丁,符合“一变多”的形式,属于分解反应,丁是分解反应的反应物,一定是化合物,故选项说法正确。
B、由质量守恒定律,参加反应的丁的质量一定等于生成甲和丙的质量,故选项说法正确。
C、生成的甲、丙两物质的质量比例为2%:16%=1:8,故选项说法错误。
D、乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法正确。
故选:C。


 高中必刷题系列答案
高中必刷题系列答案科目:初中化学 来源: 题型:
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146 mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表
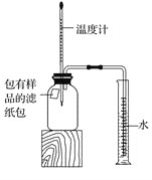
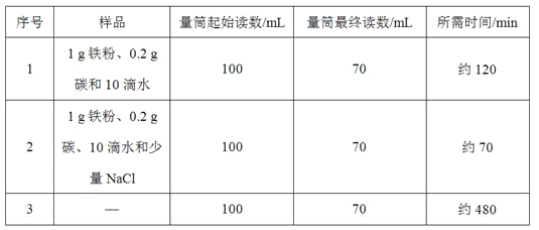
(1)实验①和②说明NaCl可以____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是______。
(4)已知碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成___。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是___(小数点后保留1位)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
与“张牙舞爪”的雾霾相比,臭氧污染“隐藏”在万里晴空中,已成为夏季众多城市的大气环境污染元凶。
2019年3月29日,中国环境科学学会臭氧污染控制专业委员会成立。该领域的众多知名专家学者共同探讨大气臭氧污染防控的方向和路径。
臭氧(O3)原本是大气中自然产生的一种具有特殊臭味的微量气体,绝大部分臭氧存在于离地面25公里左右处的大气平流层中,这就是人们通常所说的臭氧层,它吸收对人体有害的短波紫外线,防止其到达地球。可它为何又是危害环境的污染物?
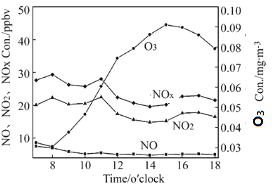
地表空气中的臭氧对人体极为有害,一些易于过敏的人长时间暴露在臭氧含量超过180微克/立方米的环境中,会产生眼睛刺痛,咳嗽等不良症状。研究表明,空气中每立方米臭氧含量增加100微克,人的呼吸功能就会减弱3%,对于运动员来说,空气中的臭氧含量可以直接影响到他们的耐力和比赛成绩。地表臭氧并不是人类活动直接排放出的污染物,而是因为氮氧化物或挥发性有机物与氧气结合而形成的,强烈的阳光照射会加速这一化学反应。氮氧化物主要来自于燃煤、汽车尾气等;挥发性有机污染物来源相对非常复杂,涂料、燃油、炼油厂、干洗店等,都会产生这种污染物。自2013年中国执行新《环境空气质量标准》,监测6种污染物以来,臭氧便成为一些城市夏季空气质量“超标日”的首要污染物,右图为某地臭氧、NO、NO2、NOX昼间12小时均值变化规律。
我国对于臭氧污染控制尚处于起步阶段,有效降低臭氧浓度依然任重而道远。
依据文章内容回答下列问题:
(1)从微观角度解释,氧气和臭氧化学性质不同的原因____不同。
(2)地表空气中的臭氧是由____生成的。
(3)如图,某地夏季某日昼时,臭氧污染最严重的时间段是____(填序号)。
A 8:00~10:00 B 10:00~12:00 C 12:00~14:00 D 14:00~16:00
(4)下列说法正确的是______(填序号)。
A 臭氧是一种无色无味气体
B 臭氧层具有吸收紫外线的作用
C 地表空气中臭氧的含量与天气阴晴无关
D 空气中臭氧浓度不同会对人体造成不同程度的影响
(5)为了减少臭氧污染,请你向市民提出一条可行建议_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家合成的新型催化剂,可将CO2高效转化为甲醇(CH3OH)。该反应的微观变化示意图如下。下列说法正确的是( )
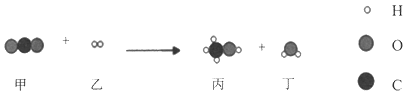
A. 该反应中四种物质均为化合物B. 反应前后氢元素的化合价不变
C. 反应前后原子数目发生改变D. 参加反应的甲、乙分子个数比为1:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】研究小组设计下列实验方案探究CO2与NaOH溶液是否发生反应。
方案一:
[查阅资料]
①乙醇不与NaOH、Na2CO3、CO2反应;
②25℃时,NaOH和Na2CO3在乙醇中的溶解度如下表:
物质 | NaOH | Na2CO3 |
溶解度/g | 17.3 | <0.01 |
[实验装置] 如图1。
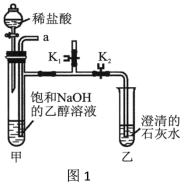
[实验步骤]
i.打开K1,关闭K2,从导管口a通入CO2气体,直至观察到饱和NaOH的乙醇溶液中产生大量沉淀,停止通CO2;
ii.从导管口a通入足量氮气;
iii.关闭K1,打开K2,向装置甲的试管中滴入足量的稀盐酸,观察装置乙的现象。
(1)步骤i产生沉淀的原因是___________________。
(2)步骤ii的目的是____________________。
(3)步骤iii装置乙中产生现象的原因是__________(用化学方程式表示)。
方案二:
[实验装置]
如图2(三颈瓶内集满CO2气体;装药品后的注射器B的活塞用夹子固定)。
[实验步骤]
按以下步骤完成实验,通过相对压强传感器测量瓶内压强的变化。整个实验过程的压强随时间变化如图3。
i.将注射器A内的NaOH溶液注入瓶中,测量压强直至不再改变;
ii.取下夹子,将注射器B内的盐酸注入瓶中,测量压强直至不再改变;
iii.将两个注射器的活塞都拉回原位,并都用夹子固定,测量压强直至不再改变。

(4)检查图2装置气密性的方法:____________。
(5)为缩短①→④中反应的时间,可采取的操作是______________。
(6)写出导致⑤→⑥压强变化的主要反应的化学方程式:________。
(7)步骤iii结束后瓶内压强比注入NaOH溶液前小,其原因是__________。
(8)请结合图3信息,说明NaOH与CO2发生了反应。_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系量如图所示。请回答下列问题:
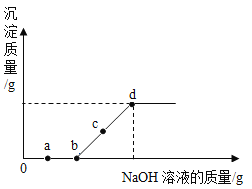
(1)a点溶液中滴入紫色石蕊试液,观察到_____。
(2)bc段(不含b点)反应的化学方程式_____。
(3)c点溶液中存在的阳离子为_____。
(4)溶液中NaCl的溶质质量分数d_____c(填“>”“<”或“=”)
(5)d点溶液中的溶质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对应的化学方程式书写正确,且反应前后有元素化合价变化的是( )
A. 铁和盐酸混合制取氢气:2Fe+6HCl=2FeCl2+3H2↑
B. 生活中用天然气作燃料:C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
C. 胃舒平(含氢氧化铝)治疗胃酸过多症:Al(OH)3+HCl=AlCl3+H2O
D. 赤铁矿(Fe2O3)高温下通CO炼铁:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】a、b、c三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答:
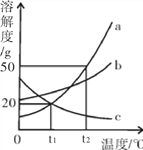
(1)t1℃时,三种物质的溶解度最大的是__________。
(2)t2℃时,将50 g固体a加入到50 g水中,充分搅拌后所得溶液的质量为_____g。
(3)将t2℃溶液质量相等的a、b、c三种物质的饱和溶液降温至t1℃,此时溶液的质量由大到小的顺序是________。
(4)下列有关说法正确的有_________。(填序号)
①其它条件不变,升高温度可使c的饱和溶液变成不饱和溶液
②t1℃时,a、c两种物质的饱和溶液中溶质的质量分数相等
③若a物质中混有少量b,可采用降温结晶的方法提纯a物质
④t2℃时,a、b、c三种物质配成的等质量饱和溶液中含溶剂质量最多的是a溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】由两种金属组成的混合物共40g,与足量稀盐酸充分反应后,共放出2g氢气。则原混合物的组成不可能是( )
A. Zn和FeB. Fe和MgC. Zn和MgD. Al和Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com