
分析 根据反应前后的质量差即为生成沉淀碳酸钡的质量,根据碳酸钡的质量可以计算反应生成氯化钾的质量,进一步可以计算所得滤液中溶质的质量分数进行分析.
解答 解:(1)反应生成的沉淀碳酸钡的质量为:60g+108.7g-149g=19.7g,
答:生成沉淀的质量为19.7g;
(2)设生成氯化钾的质量为x,
K2CO3+BaCl2=2KCl+BaCO3↓,
149 197
x 19.7g
$\frac{149}{x}$=$\frac{197}{19.7g}$
x=14.9g
所得滤液中溶质的质量分数为:$\frac{14.9g}{149g}$×100%×100%=10%,
答:氯化钾的质量分数为:10%.
故答案为:(1)19.7;
(2)10%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:解答题
 为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.
为了测定某氢氧化钠溶液中溶质的质量分数,取氢氧化钠溶液50g,向其中加入溶质的质量分数为4.9%的稀硫酸,加入稀硫酸质量与pH的变化情况如图所示.计算:当加入稀硫酸质量为20g时,所得溶液中溶质的质量分数.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
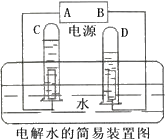 如图是电解水的简易装置.
如图是电解水的简易装置.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,滴加适量的盐酸 | 有气体产生,气体使石灰水变浑浊 | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液 | 品红褪色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 开私家车出去春游 | |
| B. | 野炊时将垃圾和未使用完的柴火焚烧 | |
| C. | 使用太阳能热水器淋浴 | |
| D. | 使用纸巾代替手帕 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com