
【题目】根据如图判断以下说法中正确的是

A.钙元素为非金属元素
B.钙的相对原子质量是40.08g
C.钙离子的核外电子数为20
D.“Ca”既可表示单质钙,又可表示钙元素
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:
【题目】向一密闭容器中加入甲、乙、丙、丁 4 种物质,在一定条件下发生化学反应,测得有关数据如图,下列说法不正确的是( )

A.a 的数值是 4
B.该反应是分解反应
C.参加反应的乙和丙的质量比为 3:5
D.丁可能是该反应的催化剂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各图能正确反映其对应变化关系的是
A.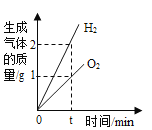 图1,电解水
图1,电解水
B.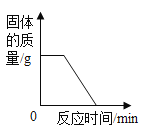 图2,加热碳和氧化铜的混合物
图2,加热碳和氧化铜的混合物
C.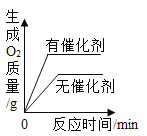 图3,用等质量、等浓度的双氧水分别制取氧气
图3,用等质量、等浓度的双氧水分别制取氧气
D.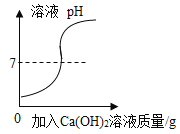 图4,向一定质量的稀盐酸中逐滴加入氢氧化钙溶液
图4,向一定质量的稀盐酸中逐滴加入氢氧化钙溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是( )
A.用赤铁矿炼铁 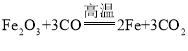 还原反应
还原反应
B.用盐酸长时间浸泡除铁锈![]() 复分解反应
复分解反应
C.实验室用过氧化氢溶液制取氧气 分解反应
分解反应
D.熟石灰处理硫酸厂的污水![]() 复分解反应
复分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类、类比是初种化学常用的学习方法。
(1)下列实验都由于压强的改变而观察到一些明显的实验现象,请从引起压强改变的原理角度,将下列实验平均分成两类,则实验 __________ (填字母)分为一类,依据是__________。
|
|
|
|
A液面下导管口产生气泡 | B液面下导管口产生气泡 | C混合后气球变大 | D气球变大 |
(2)许多物质的命名与元素的化合价髙低有关系,如氯化铁、氯化亚铁,其中铁元素的化合价分别为+3价、+2价。汞元素的化合价有+2价、+ 1价两种,由此推断氧元素和+1价汞元素组成的化合物的名称是__________,其化学式为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2019年5月11日,滨海港高铁站通车,滨海人实现了高铁出行。

(1)高铁建设施工过程中产生的废水、废浆以及机械漏油等,会对水体产生污染, 使用活性炭可对污水进行处理,这是利用了活性炭的________性。列车车体使用的镁铝合金属于________(选填 “金属材料”或“合成材料”),镁铝合金的优点是________。
(2)高铁建设中使用了大量的钢铁。工业上用赤铁矿(主要成分氧化铁)冶炼铁的化学方程式为_________。钢轨上喷防锈涂料,可防止生锈,该防锈方法的原理是________。金属矿物储量有限,保护金属资源,除防止金属锈蚀外,还可以________。(写出一条即可)。
(3)在高铁站建设中,安装了自动喷淋系统,喷出的水能灭火的原因是________。
(4)高铁信息传输系统中使用的电子芯片的关键材料是晶体硅(Si),工业上生成硅的反应是: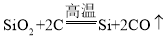 ,该反应的基本类型是_______反应。利用该反应生产含硅质量分数为98%的粗硅8吨,至少需要________吨含80%SiO2的石英砂。
,该反应的基本类型是_______反应。利用该反应生产含硅质量分数为98%的粗硅8吨,至少需要________吨含80%SiO2的石英砂。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列七种是化学中常见的物质,A在常温下是一种无色液体,D是天然气的主要成分,G是一种重要建筑材料的主要成分,E是一种金属氧化物,与A反应能生成一种常 见的碱,它们之间的转换关系如图所示:
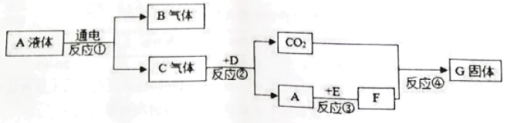
(1)写出下列物质的化学式: A_____,E_________;
(2)写出反应④的化学方程式________;
(3)E在日常生活中用途广泛,请写出其中一点_______;
(4)反应③属于__________反应(填“化合”、“分解”、 “置换”、“复分解”) ;
(5)B是最清洁的燃料,与其它燃料相比其优点是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语表示:
(1)三个硫原子_____;
(2)两个铁离子____;
(3)一个氢分子_____;
(4)标出氧化镁中镁元素的化合价________;
(5)硫酸铝_________;
(6)保持水的化学性质的最小微粒______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知烧杯中装有100g盐酸和氯化铜的混合溶液,其中含氯化铜8.1g。向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如下表。当恰好完全反应时,所得的溶液为不饱和溶液。
加入氧化铜的质量(克) | 0 | 2 | 4 | 6 | 8 | 10 |
烧杯中溶液的质量(克) | 100 | 102 | 104 | 106 | 108 | 108 |
请计算:
(1)恰好完全反应时消耗氧化铜的质量为__________g。
(2)求恰好完全反应时所得溶液的溶质质量分数(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com