
粗食盐中常含有少量
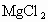 ,工业上常把粗食盐晶体粉碎后用饱和食盐水来浸洗,再滤出食盐.以下对于工业上的这种做法的有关说法正确的是
,工业上常把粗食盐晶体粉碎后用饱和食盐水来浸洗,再滤出食盐.以下对于工业上的这种做法的有关说法正确的是
[
]A
.浸洗粗食盐前后,食盐水中NaCl的质量不变B
.浸洗前后,被浸洗的食盐中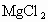 的含量不会改变
的含量不会改变
C
.浸洗用的饱和食盐水可以无限次地使用下去D
.粗食盐粉碎颗粒的大小不影响浸洗前后食盐中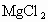 的含量
的含量 科目:初中化学 来源: 题型:阅读理解
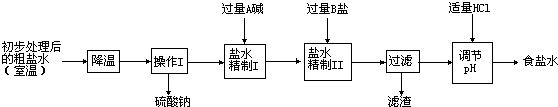
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
| ||
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:020
粗食盐中常含有少量
 ,工业上常把粗食盐晶体粉碎后用饱和食盐水来浸洗,再滤出食盐.以下对于工业上的这种做法的有关说法正确的是
,工业上常把粗食盐晶体粉碎后用饱和食盐水来浸洗,再滤出食盐.以下对于工业上的这种做法的有关说法正确的是
[
]A
.浸洗粗食盐前后,食盐水中NaCl的质量不变B
.浸洗前后,被浸洗的食盐中 的含量不会改变
的含量不会改变
C
.浸洗用的饱和食盐水可以无限次地使用下去D
.粗食盐粉碎颗粒的大小不影响浸洗前后食盐中 的含量
的含量查看答案和解析>>
科目:初中化学 来源: 题型:020
已知一种物质的饱和溶液对于该物质来说已达到饱和状态,但对于其他物质来说还可以继续溶解.粗食盐中常含有少量
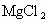 ,工业上常把粗盐晶体粉碎后用饱和食盐水来浸冼,再滤出食盐.以下对于工业上的这种做法的有关说法正确的是
,工业上常把粗盐晶体粉碎后用饱和食盐水来浸冼,再滤出食盐.以下对于工业上的这种做法的有关说法正确的是
[
]A
.浸洗粗食盐前后,食盐水中NaCl的质量不变B
.浸洗前后,被浸洗的食盐水中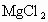 的含量不会改变
的含量不会改变
C
.浸洗用的饱和食盐水可以无限次地使用下去D
.粗盐粉碎颗粒的大小影响浸洗后食盐水中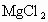 的含量
的含量查看答案和解析>>
科目:初中化学 来源:2010年中考复习第一次质量检查化学试卷(解析版) 题型:解答题

| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com