
| ||
| △ |
| 149 |
| x |
| 96 |
| 9.6g |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
| 149 |
| 96 |
| X |
| 4.8g |
| 149 |
| 96 |
| X |
| 4.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:
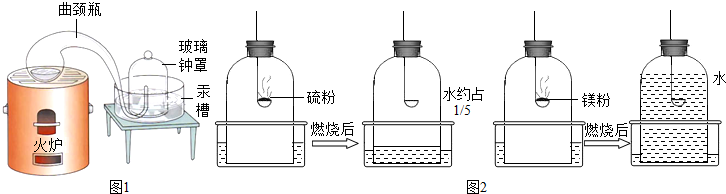
十八世纪法国化学家拉瓦锡为了研究空气的组成设计 了一个划时代意义的钟罩实验(如右图),该实验证明了空气中氧气约占空气的体积1/5。
①拉瓦锡在观察到汞面浮起红色渣滓后,还继续加热12天,至红色渣滓不再增加,这样做的理由是 (1) ,该反应的化学方程式是(2) 。
②拉瓦锡得到的红色渣滓是氧化汞,他又将氧化汞加热分解得到氧气,而现在实验室检验氧气的方法可以是(3) 。
 ③实验室常用白磷燃烧来验证空气中氧气约占1/5,小张同学利用实验室现有的药品硫粉和镁粉,利用下列钟罩装置进行实验,燃烧完毕冷却后的结果如图:
③实验室常用白磷燃烧来验证空气中氧气约占1/5,小张同学利用实验室现有的药品硫粉和镁粉,利用下列钟罩装置进行实验,燃烧完毕冷却后的结果如图:
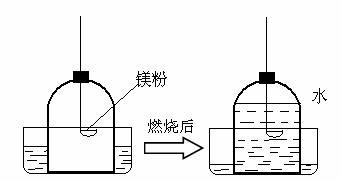
写出硫粉在钟罩内燃烧的化学方程式(4) ,燃烧的现象是(5) 。
如果实验仪器气密性良好,所用的硫粉、镁粉都是足量的。根据实验结果,推测可能的原因,硫粉燃烧后水进入约1/5的原因是(6) ;镁粉燃烧后水几乎占满整个钟罩的原因是(7) 。
④现在实验室中得到氧气,可以利用氯酸钾受热分解,实验操作时要用到酒精灯、导管、铁架台等,还需用到的玻璃仪器有(8) ;目前实验室不用氧化汞加热分解的方法制取氧气的理由是(9) 。
⑤若实验室利用12.25g氯酸钾与3gMnO2混合加热,请写出化学反应方程式,并列式计算最多可以得到多少物质的量的氧气?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com