
【题目】小明测得碳酸钙与一定量的稀盐酸反应后的溶液pH为2,取适量该溶液向其中逐滴加入碳酸钠溶液,并测得溶液pH随加入碳酸钠溶液体积的变化曲线如图所示。下列说法不正确的是:( )

A.AB段处溶液的质量增加
B.AB段产生气泡,BC段产生沉淀
C.B、C二点的溶液中的溶质相同
D.CD段溶液显碱性是因为碳酸钠过量
【答案】C
【解析】
碳酸钙与一定量的稀盐酸反应后的溶液pH为2,说明稀盐酸过量,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2![]() ,反应后溶液中溶质含有CaCl2和HCl,向其中逐滴加入碳酸钠溶液,碳酸钠会先与稀盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2
,反应后溶液中溶质含有CaCl2和HCl,向其中逐滴加入碳酸钠溶液,碳酸钠会先与稀盐酸反应Na2CO3+2HCl=2NaCl+H2O+CO2![]() ,这也是图像AB段发生的反应;B点时盐酸恰好反应完,此时溶液中溶质为CaCl2和NaCl ,BC段发生CaCl2+ Na2CO3= CaCO3
,这也是图像AB段发生的反应;B点时盐酸恰好反应完,此时溶液中溶质为CaCl2和NaCl ,BC段发生CaCl2+ Na2CO3= CaCO3![]() +2 NaCl,C点时氯化钙恰好反应完,溶液中只有氯化钠;CD段没有物质与碳酸钠反应,继续加入碳酸钠溶液造成过量。
+2 NaCl,C点时氯化钙恰好反应完,溶液中只有氯化钠;CD段没有物质与碳酸钠反应,继续加入碳酸钠溶液造成过量。
A. 根据以上分析,AB段发生Na2CO3+2HCl=2NaCl+H2O+CO2![]() ,向反应后的溶液中加入碳酸钠溶液,增加碳酸钠溶质和溶剂水的质量,同时跑出去气体CO2质量,根据反应方程式,增加的碳酸钠的质量要大于减少的二氧化碳质量(Na2CO3相对分子质量106,大于CO2相对分子质量44),再加上碳酸钠溶液中的溶剂水的质量,AB段处溶液质量会增加,故A不符合题意;
,向反应后的溶液中加入碳酸钠溶液,增加碳酸钠溶质和溶剂水的质量,同时跑出去气体CO2质量,根据反应方程式,增加的碳酸钠的质量要大于减少的二氧化碳质量(Na2CO3相对分子质量106,大于CO2相对分子质量44),再加上碳酸钠溶液中的溶剂水的质量,AB段处溶液质量会增加,故A不符合题意;
B. 根据以上分析,AB段发生Na2CO3+2HCl=2NaCl+H2O+CO2![]() ,所以有气泡产生;BC段发生CaCl2+ Na2CO3= CaCO3
,所以有气泡产生;BC段发生CaCl2+ Na2CO3= CaCO3![]() +2 NaCl,所以有白色沉淀碳酸钙产生,故B选项不符合题意;
+2 NaCl,所以有白色沉淀碳酸钙产生,故B选项不符合题意;
C. 根据以上分析, B点时碳酸钠与盐酸恰好反应完,此时溶液中溶质为CaCl2和NaCl,C点时碳酸钠与氯化钙恰好反应完,溶液中只有氯化钠,故C选项符合题意;
D. CD段没有物质与碳酸钠反应,继续加入碳酸钠溶液造成过量。碳酸钠溶液显碱性,pH增大,故D选项不符合题意;
故选:C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
【题目】铁是人体必需的微量元素之一,如图标签是某药厂生产的硫酸亚铁糖衣片说明,请回答:
(1)硫酸亚铁中Fe、S、O的原子个数比为______;
(2)硫酸亚铁的相对分子质量为______,其中铁元素的质量分数为______(精确到0.1%);按服用说明成人每天补铁______mg.(假设所需铁元素全部来自补铁剂)

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钙是维持人体正常功能所必需的元素.如图所示为某种补钙剂“钙尔奇”说明书的一部分.取1片钙尔奇,放入盛有10g稀盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其他成分与稀盐酸不反应),烧杯内物质的质量为11.34g.试计算:

(1)每片钙尔奇中含碳酸钙的质量.
(2)使用这种补钙剂,每人每天摄入钙元素的质量.
(3)所用稀盐酸中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)
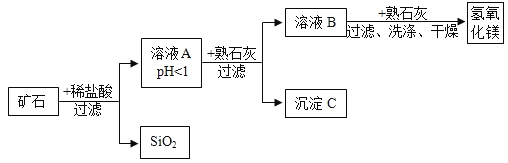
请回答下列问题:
(1)写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式______(只写一个)。
(2)在过滤操作中,玻璃棒的作用是______。
(3)在溶液A中加入熟石灰调节溶液的pH可以使溶液中的金属阳离子逐步转化为沉淀。在该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为______
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(4)写出在溶液B中加入熟石灰发生的化学反应方程式:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用的原理( 用化学方程式表示)及基本反应类型均正确的是( )
A.用红磷测定空气中氧气含量:4P+5O2![]() 2P2O5 氧化反应
2P2O5 氧化反应
B.用赤铁矿高炉炼铁:Fe2O3+3CO![]() 2Fe+3CO2 置换反应
2Fe+3CO2 置换反应
C.硫酸厂污水可用熟石灰中和处理:H2SO4+Ca(OH)2 = CaSO4+H2O 复分解反应
D.加热高锰酸钾制取氧气:2KMnO4![]() K2MnO4+MnO2+ O2↑ 分解反应
K2MnO4+MnO2+ O2↑ 分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室中有一瓶瓶盖长期打开的氢氧化钠固体样品,某兴趣小组的同学对该样品的成分及含量进行探究。
(发现问题)该样品中含有哪些物质?
(查阅资料)①NaOH在空气中易于空气中的二氧化碳反应,但不会转化成NaHCO3。
②BaCl2溶液呈中性,Ba(OH)2是可溶性强碱。
③CO2在饱和的NaHCO3溶液中几乎不溶解。
(提出猜想)猜想Ⅰ:NaOH; 猜想Ⅱ:Na2CO3 猜想Ⅲ:NaOH和Na2CO3
(设计实验)
实验操作 | 实验现象 |
| 步骤①:样品全部溶解 |
(收集证据)
(1)若现象A是有气泡产生,则X溶液为__________,则________(填“猜想Ⅰ”、“猜想Ⅱ”或“猜想Ⅲ”)不成立。
(2)若X溶液为BaCl2溶液,现象A是有白色沉淀生成,则产生该沉淀的化学方程式为_______________。取反应后的上层清液,测定其pH,当pH________7(填“>”、“<”或“=”),则证明猜想Ⅲ成立。
(定量分析)
确定部分变质样品中Na2CO3的质量分数。兴趣小组的同学用如图所示装置进行实验。步骤如下:
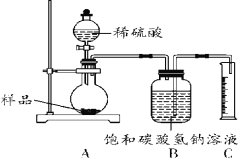
①按图连接好装置,并检查气密性;
②准确称取该样品1.0 g,放入烧瓶内;
②打开活塞,滴加30.0%的稀硫酸至过量,关闭活塞;
③反应结束后,量筒内液体读数为55.0 mL。
(已知:室温条件下,CO2的密度约为1.6 g/L)
(1)B装置集气瓶内原有的空气对实验结果________(填“有“或“没有”)影响。饱和碳酸氢钠溶液如果用水代替,则所测CO2的体积________(填“偏大”、“偏小”或“不变”)。
(2)计算该固体样品中Na2CO3的质量分数为_________。(计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常用二氧化锰催化过氧化氢溶液分解的方法制取氧气。该实验速率快,产物无污染,某实验小组进行了如下探究。
(探究实验)书本介绍了除了用二氧化锰外,硫酸铜溶液也可以催化过氧化氢溶液的分解,查阅资料得知,氯化铁溶液也可以催化过氧化氢溶液的分解。那么,硫酸铜溶液和氯化铁溶液催化的效果怎么样呢?请根据下表四组实验现象,回答下面问题
序号 | 催化剂 | 实验步骤 | 实验现象 | 实验结论 |
1 | FeC13溶液 | 向5mL4%的H2O2溶液,滴5滴0.1%FeC13溶液 | 试管中产生大量气泡 | FeC13溶液对H2O2的分解有较好的催化效果 |
2 | FeC13溶液 | 向5mL12%的H2O2溶液,滴5滴0.1%FeC13溶液 | 试管中有适量气泡 | |
3 | CuSO4溶液 | 向5mL4%的H2O2溶液,滴5滴0.1%CuSO4溶液 | 试管中产生少量气泡 | CuSO4溶液对H2O2的分解催化效果一般 |
4 | CuSO4溶液 | 向5mL12%的H2O2溶液,滴5滴0.1%CuSO4溶液 | 试管中气泡量很少 |
(思考分析)
(1)CuSO4属于______(填“酸”或“碱”或“盐”)
(2)请你写出用二氧化锰催化过氧化氢溶液分解的反应方程式______。
(3)通过实验____(填序号)可以比较硫酸铜溶液和氯化铁溶液催化过氧化氢溶液分解的效果。
(4)请你从上面的实验,选择一组合适的药品进行实验室制取氧气,____%H2O2溶液,______(填催化剂的种类和浓度)。
(5)从上面的实验中,你还能得到什么结论______。
(拓展延伸)
(6)在老师的鼓励下,同学们继续探究FeCl3溶液中到底是哪种粒子催化H2O2的分解,请你设计一组实验进行探究______。
(7)另一名同学了解到,加热也可促进过氧化氢溶液分解,于是进行如下实验,分别取5mL12%的H2O2溶液于试管中进行水浴加热,步骤和现象如下:
序号 | 加热耗时 | 水浴温度 | 分解现象 |
1 | 12分 | 65℃ | 少量气泡 |
2 | 15分 | 74℃ | 明显气泡 |
3 | 21分 | 87℃ | 大量气泡 |
根据该同学的探究,试分析回答,为什么实验室通常不用加热过氧化氢溶液的方法制氧气?(两点理由):______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求:

(1)混合物CaCO3中的质量为 ;
(2)稀盐酸中的溶质质量分数为 ;
(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数?(写出计算过程,计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类法在日常生活和科学研究中具有广泛的应用。化学实验可以按照实验目的分为:“探究物质性质实验、探究物质含量实验、探究反应条件实验”等。请回答问题:
(1)我们可以将实验D与实验_____(填字母)分为一类,分类依据是________。
A | B | C | D |
|
|
|
|
(2)某同学做中和反应实验时,用pH传感器测得溶液的pH变化如图所示。

①向A点溶液中滴加紫色石蕊溶液,实验现象是______
②C点溶液中有_____种溶质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com