
【题目】某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:

(1)A点之前都是氢氧化钠与 _______ 反应 ;
(2)反应至A点时,消耗氢氧化钠溶液的质量为_____g ;
(3)计算反应至B点时锥形瓶内所得溶液的溶质质量分数为_____?(计算结果保留至0.1%)
【答案】盐酸 40g 10.4%
【解析】
(1)向混合溶液中逐滴加入氢氧化钠溶液,根据“优先反应”原则,氢氧化钠先与稀盐酸反应生成氯化钠和水,待稀盐酸完全反应后,氢氧化钠再与氯化铜反应生成氢氧化铜和氯化钠,故A点之前都是氢氧化钠与盐酸反应;
(2)氢氧化钠与稀盐酸反应生成氯化钠和水,溶液增加的质量,就是加入的氢氧化钠的质量,反应至A点时,溶液增加40g,消耗氢氧化钠溶液的质量为40g;
(3)解:设氢氧化钠与盐酸反应生成氯化钠的质量为x

![]() x=5.85g
x=5.85g
设氢氧化钠与氯化铜反应生成氯化钠的质量为y,生成氢氧化铜的质量为z

![]() y=23.4g
y=23.4g
![]() z=19.6g
z=19.6g
反应至B点时锥形瓶内所得溶液的溶质质量分数为:
![]() 。
。
答:反应至B点时锥形瓶内所得溶液的溶质质量分数为10.4%。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:初中化学 来源: 题型:
【题目】依据下列实验数据和溶解度曲线回答以下小题。
① | ② | ③ | ④ | |
温度 | 10℃ | 10℃ | 30℃ | 30℃ |
固体种类 | KNO3 | NaCl | KNO3 | NaCl |
固体质量 | 30g | 30g | 40g | 40g |
水的质量 | 100g | 100g | 100g | 100g |

【1】①~④所得的溶液中,属于不饱和溶液的是( )
A.①和②B.②和③C.③和④D.①和④
【2】下列说法中,正确的是( )
A.溶质质量:①=②B.溶液质量:②>③
C.溶质与溶剂质量比:①=③D.溶质质量分数:③>④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以空气等为原料可合成氨、尿素[CO(NH2)2],以下是简易生产流程的一部分。
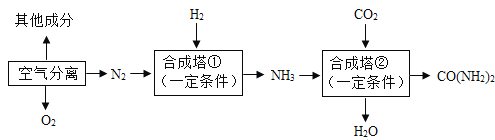
(1)工业合成氨的原料是氮气和氢气,氮气可从空气分离中获得。此空气分离的变化属于_____(填“物理变化”或“化学变化”)。
(2)写出合成塔①中合成氨的化学方程式,_____该反应的反应类型是_____。
(3)写出合成塔②中合成尿素的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶久置的氢氧化钠固体,李璧凝同学想了解其变质情况,称取 9.3g 干燥的样品,加水使其完全溶解,然后向其中逐滴滴加氢氧化钙溶液,所得沉淀质量与加入氢氧化钙溶液质量关系如下表所示:
实验编号 | ① | ② | ③ | ④ |
氢氧化钙溶液质量/g | 100 | 200 | 300 | 400 |
沉淀质量/g | 2 | m | 5 | 5 |
(1)实验②中 m 的数值为_________________。
(2)计算该氢氧化钠固体中碳酸钠的质量分数____________。(写出计算过程,结果精确到 0.1%)
(3)请在下图中画出生成沉淀质量随加入氢氧化钙溶液质量变化的曲线图,并标出图中的必要数据______________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列对反应的化学方程式书写完全正确的是( )
A.铁丝在氧气中燃烧:2Fe+3O2![]() 2Fe2O3
2Fe2O3
B.一氧化碳还原氧化铁:3CO+Fe2O3═2Fe+3CO2
C.在密闭容器中燃烧红磷验证质量恒定律:2P+O2![]() P2O5
P2O5
D.用澄清的石灰水检验二氧化碳气体:CO2+Ca(OH)2═CaCO3↓+H2O
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】锂被誉“21世纪的能源金属”,锂是一种银白色、质软、自然界密度最小的金属。如图是锂元素的原子结构示意图及其在周期表中的相关信息。
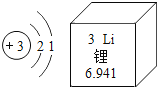
(1)锂元素位于元素周期表中第___周期,在化学反应中容易____(填“得到”或“失去”)电子,其离子符号为______。
(2)研究表明,锂的金属活动性比较活泼。锂与稀硫酸反应的化学方程式为_____,该反应的基本类型为_____。
(3)氢氧化锂(LiOH)是一种易溶于水的白色固体,与氢氧化钠的化学性质相似,是因为在水溶液中都能解离出_____(填“金属”“氢”或“氢氧根”)离子。氢氧化锂与二氧化碳反应的化学方程式为_____,在航天舱内如果要吸收航天员呼出的二氧化碳气体,用氢氧化锂比氢氧化钠更理想,分析其原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如图所示(不含结晶水),请回答:
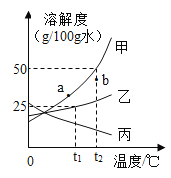
(1)0℃时,甲、乙、丙的溶解度最大的是_______。
(2)t2℃时,将30g甲固体加入到50g水中,充分搅拌后的所得溶液是_______(填“饱和”“不饱和”)。
(3)若甲中含有少量乙,应用__________法提纯甲。
(4)等质量的甲、乙、丙三种饱和溶液从t2℃降温至0℃后,溶液的质量分数由大到小的顺序是______________。
(5)若使甲溶液的状态从a点转化为b点,可采取的措施是__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析处理图表中的信息是学习化学的一种重要方法。运用溶解度表与溶解度曲线回答问题:
温度/°c | 0 | 10 | 20 | 30 | 40 | 50 |
NH4C1溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36,3 | 36. 6 | 37.0 |
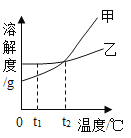
(1)氯化钠的溶解度曲线是_____(填"甲”或“乙”)。
(2)20℃时,将40 gNH4Cl加入100 g的水中,充分搅拌后得到的是______(填“饱和”或“不饱和”)溶液。将上述溶液升温到30 °C,该溶液的溶质质量分数为__
(3)t1 °C时,将甲、乙两种物质的饱和溶液各100 g分别恒温蒸发5 g水,析出晶体最多的是_____(填“甲”或'乙”)。
(4)计算配制50 g质量分数为3%的NaCl溶液所需质量分数为6%的NaCl溶液的体积,需要用到的数据是_____(填字母)。
A 3%的NaCl溶液的密度 B 水的密度 C 6%的NaCl溶液的密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com