
工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下: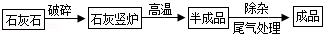
(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是 t.
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)
科目:初中化学 来源: 题型:计算题
长期使用的水壶底部结有一层水垢,其主要成分是碳酸钙和氢氧化镁,为较准确测定水垢中氢氧化镁的含量,实验小组分别取三份同样的水垢样品各7.00g,利用如图所示装置连续进行三次实验,并将每次实验中装置B的质量变化记录于下表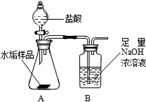
| | 第一次 | 第二次 | 第三次 | 平均值 |
| B装置增加的质量 | 2.17 | 2.22 | 2.21 | |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在学习酸和碱的知识时,王老师将几块氢氧化钠放在表面皿中,放置在教室的橱柜里,过了几天,表面皿中块状固体出现了许多白色粉末,同学们就此展开探究.
(1)小杰猜想粉末是碳酸钠,原因的化学方程式是 .
(2)小鑫用两种不同类别的物质检验出了碳酸钠的存在,他选用的试剂是 和 .
(3)小源取少量固体样品,配成溶液加入无色酚酞来检验,发现溶液变红色,说明溶液中一定存在的物质是 (填化学式)
(4)喜欢动手的壮壮同学设计出了实验装置如图所示.实验时向试管里的水中加入固体氢氧化钠后,原来U形管内两臂在同一水平面上的红墨水,右面液面将 .(填“上升”或“下降”)原因是 .如果要观察到相反的现象,可以向水中加入 .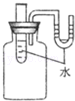
(5)73g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,计算所得溶液中溶质的质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
汽车尾气排放出的气体主要有NO和NO2,它们污染环境,可用氨气(NH3)除去。
反应的化学方程式为:2NH3 + NO + NO2催化剂 2N2 +3H2O。若反应后得到56g N2,理论
上消耗氨气多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
长时间使用的热水壶底部有一层水垢,主要成分是CaCO3。某校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量。他们取100g水垢,加入足量的稀盐酸,同时测量5分钟(min)内生成CO2质量,测量数据如下表:
| 时间/ min | 1 | 2 | 3 | 4 | 5 |
| 生成CO2的质量/g | 15 | 25 | 30 | 33 | 33 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定某赤铁矿石中氧化铁的质量分数,某化学兴趣小组的同学用过量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用100g氢氧化钠溶液恰好完全吸收,形成不饱和溶液.该溶液总质量与反应时间的变化关系如图.试分析解答: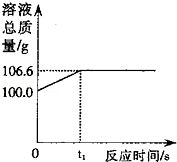
(1)赤铁矿石中所含主要物质的颜色为: .
(2)实验中多余的一氧化碳能否用水吸收? .
(3)上述反应中产生二氧化碳的质量为 g.
(4)计算实验结束后所得不饱和溶液中所含溶质的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
盐水选种是我国古代劳动人民发明的一种巧妙的挑选种子的方法.农业生产上常用质量分数为15%﹣20%的氯化钠溶液来选种.
(1)要配置150kg16%的氯化钠溶液,计算应称取氯化钠的质量.
(2)选种进行一段时间后,农技员估计溶液和溶质质量分数都有所减少,他取出50g氯化钠溶液,加入过量AgNO3溶液,得到沉淀14.35g,计算氯化钠溶液中溶质的质量分数.
(3)若此时氯化钠溶液的质量只剩下100kg,要使溶液质量和溶质质量分数都恢复到(1)中的状态,计算需要加入的氯化钠和水的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
用氯化钠和碳酸氢铵(NH4HCO3)可制备碳酸氢钠和氯化铵(NH4Cl),该反应可表示为:NaCl+NH4HCO3═NaHCO3+NH4Cl.
20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7g NaCl
和15.8g NH4HCO3.请计算:
(1)理论上从溶液中析出晶体的质量为多少g?
(2)反应后所得溶液中溶质NH4Cl的质量分数是多少?(写出计算式即可).
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变.
| 物质 | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| 溶解度/g | 36.0 | 21.6 | 37.2 | 9.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com