
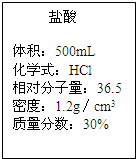
 实验室保存的-瓶浓盐酸:瓶和的标签的部分内容如图所示,请你根据标签上提供的数据回答下列问题.
实验室保存的-瓶浓盐酸:瓶和的标签的部分内容如图所示,请你根据标签上提供的数据回答下列问题.| 溶质质量 |
| 溶质质量分数 |
| 样品中碳酸钙的质量 |
| 样品质量 |
| 溶质质量 |
| 溶液质量 |
| 73 |
| 44 |
| 7.3g |
| x |
| 73 |
| y |
| 7.3g |
| 11.1g |
| 73 |
| 100 |
| 7.3g |
| z |
| 11.1g |
| 45.3g |


科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:
| 盐 酸 体积:500mL 化学式:HCl 相对分子质量:36.5 密度:1.19g/cm3 质量分数:37%(1)瓶内浓盐酸的质量是 (2)用10mL浓盐酸可以配制溶质的质量分数为10%的盐酸溶液 查看答案和解析>> 科目:初中化学 来源: 题型:解答题 实验室保存的一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题.(计算结果精确到0.01)
(2)用10mL浓盐酸可以配制溶质的质量分数为10%的盐酸溶液________g. 查看答案和解析>> 科目:初中化学 来源:不详 题型:填空题 实验室保存一瓶浓盐酸,瓶上的标签部分内容如图所示,请根据标签上的信息回答下列各问:(结果精确到0.01) 这一瓶浓盐酸的质量是______,溶质的质量是______.
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |