
【题目】下列物质混合,经点燃充分反应后一定得到纯净物的是:
A. 质量比为4:7的氧气和一氧化碳B. 体积比为5:2的空气和氧气
C. 分子数比为1:2的甲烷和氧气D. 原子数比为4:1的氢气和氧气
【答案】A
【解析】
A、根据化学方程式2CO+O2![]() 2CO2可知,氧气和一氧化碳的质量比=32:56=4:7。质量比为4:7的氧气和一氧化碳恰好完全反应生成二氧化碳,经点燃充分反应后一定得到纯净物,故A正确;
2CO2可知,氧气和一氧化碳的质量比=32:56=4:7。质量比为4:7的氧气和一氧化碳恰好完全反应生成二氧化碳,经点燃充分反应后一定得到纯净物,故A正确;
B、体积比为5:2的空气和氧气不能发生反应,还是混合物,故B错误;
C、根据化学方程式CH4 + 2O2 ![]() CO2 + 2H2O可知,甲烷和氧气分子数比为1:2,分子数比为1:2的甲烷和氧气恰好完全反应生成二氧化碳和水,点燃充分反应后一定得到混合物,故C错误;
CO2 + 2H2O可知,甲烷和氧气分子数比为1:2,分子数比为1:2的甲烷和氧气恰好完全反应生成二氧化碳和水,点燃充分反应后一定得到混合物,故C错误;
D、根据化学方程式2H2 + O2 ![]() 2H2O可知,氢气和氧气恰好完全反应原子个数比为4:2,原子数比为4:1的氢气和氧气,经点燃充分反应后,氧气有剩余,得到氧气和水的混合物;故D错误。故选A。
2H2O可知,氢气和氧气恰好完全反应原子个数比为4:2,原子数比为4:1的氢气和氧气,经点燃充分反应后,氧气有剩余,得到氧气和水的混合物;故D错误。故选A。


科目:初中化学 来源: 题型:
【题目】通过下列实验,能达到实验目的是( )
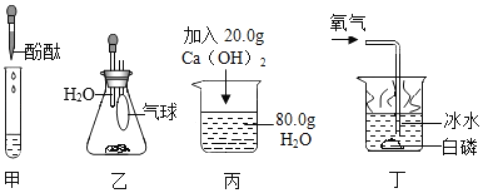
A. 根据甲试管中溶液颜色深浅,比较盐酸和碳酸的酸性强弱
B. 根据乙中气球的大小变化,比较NaOH和NH4NO3固体溶解的热效应
C. 丙烧杯中装有80g水,加入20g氢氧化钙,能配制出20%的Ca(OH)2溶液
D. 通过观察丁中的实验现象,说明燃烧的条件之一是必须与氧气接触
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活、生产关系密切.请回答下列问题:

①如图为某抗酸药的实物图.该图标示的物质中,含有的金属元素是______(写出一种即可).
②沾染了油污的衣物用洗洁精就可以洗干净,这是利用了洗洁精的______作用.
③生产加碘盐通常是在食盐中加入碘酸钾(KIO3),碘酸钾中碘元素的化合价为______价.
④某种抗酸药的主要成分是三硅酸镁(Mg2Si3O8),能与盐酸发生复分解反应,则反应后产物中含镁的化合物是______(写化学式)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于测定空气中氧气的含量实验(图中药品为红磷和水)的分析中,不正确的( )
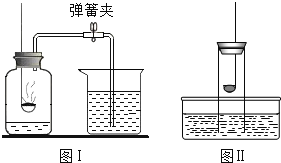
A. 氮气不与红磷反应且难溶于水,是设计该实验的依据之一
B. 不能用木炭代替红磷
C. 图Ⅰ中进入广口瓶的水约占烧杯中水的五分之一
D. 图Ⅱ所示装置也可以测定空气中氧气含量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以黄铁矿(主要成分是FeS2)为原料,生产硫酸的简要流程如图,有关说法正确的是

A. 该流程图中生成物都是氧化物,生成过程必须防止泄漏产生污染
B. 炉渣(Fe2O3)在工业上可用来炼铁
C. 流程中SO2转化为SO3的化学方程式为SO2 + O2 == SO3
D. 将黄铁矿粉碎,目的是增大接触面积,加快反应速度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】等质量甲、乙、丙三种金属分别放入三份浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知甲、乙、丙在生成物中的化合价均为+2价)。则下列说法中错误的是( )
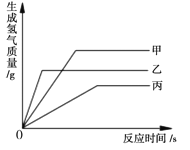
A. 生成氢气的质量:甲﹥乙﹥丙
B. 相对原子质量:乙﹥丙﹥甲
C. 金属活动性:乙﹥甲﹥丙
D. 消耗硫酸的质量:甲﹥乙﹥丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列是配制一定溶质质量分数的氯化钠溶液的实验图示。请回答下列问题:

(1)在量取水的操作中,当水面接近所需刻度时,应使用______添加水。
(2)指出图A中的错误操作______。
(3)将图A中错误操作改正后,用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,接下来的操作应是______。
(4)在其他操作无错误的前提下,量取所需要的水时,按图B进行操作,一定能导致所配制溶液的溶质质量分数______(填“偏大”、“不变”或“偏小”)。
(5)图D中玻璃棒的作用是______
(6)实验室用50g98%的浓硫酸配制成20%的稀硫酸,需要水的质量______g.配制该溶液的操作方法是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国古代科技高度发达,对中国古代著作涉及化学的叙述,下列解读不正确的是( )
A. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
B. ![]() 本草纲目
本草纲目![]() 中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是
中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的“碱”是![]()
C. “青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】CO2可用于制备碳酸饮料,人饮后有清凉感。某同学设计如下实验,测定某品牌碳酸饮料中的CO2的含量。

实验步骤:
①将250mL瓶装碳酸饮料放在冰箱中冷冻至刚好结冰;
②将饮料从冰箱内取出,迅速加入质量分数为50%NaOH溶液5mL;倒转饮料瓶,轻轻震荡,完全反应,然后放置恢复至室温,待测定;
③称得装置D的质量为xg,按上图连接实验装置。将步骤②中待测液全部加入仪器②中,关闭开关a,打开仪器①的活塞,向仪器②中注入稀盐酸,至不再产生气泡,关闭仪器①的活塞;
④打开开关a,向装置中鼓入空气,一段时间后,称量D装置质量为yg.
注:实验中各种溶液的密度都视为1g/mL.碱石灰是CaO与NaOH的固体混合物。
(1)步骤②中发生反应的化学方程式为_____.
(2)步骤①冷冻碳酸饮料的目的是_____;装置E的作用是_____.
(3)根据题中提供的数据计算此品牌碳酸饮料中CO2的含量为_____g/L.
(4)步骤④鼓入空气的目的是_____.
(5)若没有C装置,则测得CO2含量会_____.(填“偏大”或“偏小”“无法确定”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com