
【题目】某研究性学习小组对中和反应进行探究,请你参与实验.
(探究活动1):证明酸和碱发生了反应.
稀盐酸和NaOH溶液混合没有明显现象,小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是__________.反应的化学方程式________________.

(探究活动2):能否通过证明有水生成来证明其反应的发生?
(设计实验)小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验.
(小资料)a 变色硅胶吸水后由蓝色变为红色
b 醋酸是一种酸,常温下为无色液体
(1)实验①、②的实验目的是______________;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是_____________.
(3)能证明酸和碱反应有水生成的现象是________________.
(探究活动3):能否通过测量酸和碱反应过程的pH、温度变化证明其反应的发生?取一定量的稀盐酸,逐滴匀速滴加NaOH溶液,用电子传感器实时获得溶液的pH、温度曲线如图3.
(4)由图3你得到的规律请写出两条. ___________________.
【答案】滴有酚酞的氢氧化钠溶液由红色变成无色 NaOH+HCl=NaCl+H2O 证明了无水醋酸和氢氧化钠不含有水,不能使硅胶变色 防止空气中的水分进入试管干扰试验 试管③中的硅胶由蓝色变为红色,试管①②中的硅胶不变色 溶液的pH增大;中和反应放热等
【解析】
[探究活动1]无色酚酞试液在氢氧化钠溶液中显红色,滴入了稀盐酸变成了无色,说明了盐酸与氢氧化钠发生了反应产生氯化钠和水,反应的化学方程式为NaOH+HCl=NaCl+H2O;
[探究活动2](1)通过实验①、②的实验现象的对比证明了无水醋酸和氢氧化钠不含有水,不能使硅胶变色,由试验③硅胶的变色说明了中和反应有水生成;
(2)空气中含有水,也能使硅胶变色,迅速塞紧橡胶塞可防止空气中的水分进入试管干扰试验;
(3)能证明酸和碱反应有水生成的现象是:实验①②对比,③硅胶颜色的变化;
[探究活动3]由pH曲线随着滴入的氢氧化钠的增多,pH增大,当t1时pH=7,说明了酸与碱发生了中和反应;由温度的变化曲线可以看出,曲线逐渐上升,说明了中和反应是放热反应。


科目:初中化学 来源: 题型:
【题目】侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品12.5g,将其放入干净的烧杯中,加入100g水,使其完全溶解。向所得溶液中加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
(1)B点时,烧杯中溶液里存在的粒子为______(填写粒子符号)。
(2)A点时,求此温度下所得不饱和溶液中溶质的质量______。(写出具体计算过程,计算结果精确至0.1g)。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】a、b两种物质的溶解度曲线如图所示。下列说法错误的是
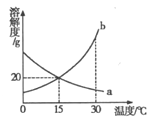
A.15℃时,a、b的溶解度均为20g
B.15℃时,将15g b放入50g水中,充分溶解后,所得溶液质量是65g
C.加水或升温均可使b的饱和溶液变为不饱和溶液
D.将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组在收集的一塑料瓶氧气中插入氧气传感器探头对微粒的运动进行探究(如图1)。实验步骤为:①敞口放置;②双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下实时测出氧气的体积分数随时间变化的曲线(如图2)。下列有关说法错误的是( )

A.MN段最能说明分子是不断运动的
B.NP段和MN段相比,说明温度升高,分子运动加快
C.Q点氧气浓度最低说明氧分子静止不动
D.PQ段变化是因为氧气的密度比空气大氧分子更快更多地从瓶口向下逸出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钛和钛合金被认为是21世纪的重要金属材料,被广泛用于火箭,导弹,航天飞机船舶等,下图为某化工企业生成钛流程示意图:
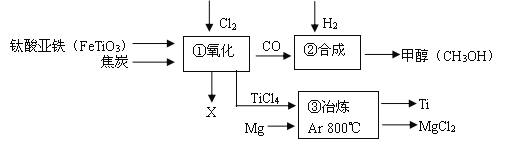
请回答下列问题:
(1)FeTiO3中钛元素的化合价为: ;
(2) ①中化学方程式为2FeTiO3+6C +7Cl2 ![]() 2X +2TiCl4 +6CO,则 X为
2X +2TiCl4 +6CO,则 X为
(填化学式)。
(3)②中CO和H2以化学计量数1:2恰好完全反应,则该反应的基本反应类型是 。
(4)③中氩气的作用是 ,
该步反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室制取气体常用的装置。结合图示回答下列问题:

(1)写出B图中仪器Ⅰ的名称_______。
(2)实验室用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,选用的发生装置是______(填字母序号)。
(3)实验室利用大理石和稀盐酸反应制取二氧化碳,可选用B发生装置,装置中使用分液漏斗的优点是____。
(4)实验室用双氧水和二氧化锰制取一瓶干燥的氧气,仪器接口的连接顺序是______ (填导管接口的字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图1所示,连接好装置和压强传感器。气密性良好的烧瓶内充满CO2.分别用注射器向烧瓶中迅速注入等量的水、饱和石灰水和40%的氢氧化钠溶液,关闭活塞,一段时间后再振荡烧瓶。观察传感器所示气压变化如图2所示。下列说法错误的是( )

A. 曲线2代表加入的是水
B. 吸收![]() 用NaOH溶液较合适
用NaOH溶液较合适
C. AB段气压增大的原因之一是液体的添加使气体体积缩小
D. 曲线1中CD段气压“急速”减少的原因是振荡烧瓶使瓶内气体迅速反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2020年3月22日“世界水日”和“中国水周”活动的宣传主题为“坚持节水减排,建设幸福河湖”。
(1)根据下图回答问题:
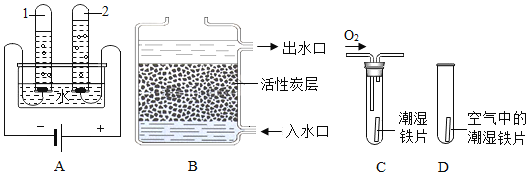
①A图所示的是电解水的简易装置,试管2中收集的气体是_____(填名称);
②B图所示的是活性炭净水器的示意图,其中利用了活性炭的_____ 性;
③C、D图所示的是探究铁生锈条件的实验,一段时间后发现C中铁片变红,D中铁片依然光亮,对比C、D中的现象,说明决定铁生锈快慢的一个重要因素是:_____。
(2)若用质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3)配制110g质量分数为5%的氢氧化钠溶液。
①计算:需要10%的氢氧化钠溶液体积为_____毫升;
②量取:用量筒量取氢氧化钠溶液和水,均倒入烧杯中。若量取氢氧化钠溶液读数时俯视,而其余操作均正确,这样配得的溶液的溶质质量分数会_____(填“偏高”、“偏低”或“无影响”);
③混匀:用_____搅拌,使氢氧化钠溶液和水混合均匀。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
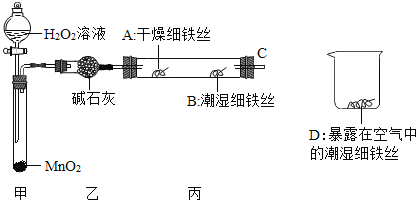
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______。
(2)反应开始后,甲装置中反应现象是______,MnO2的作用______。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关。B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______。
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:![]() ,
,![]() ,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3H2O178,FeCO3116)
,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3H2O178,FeCO3116)
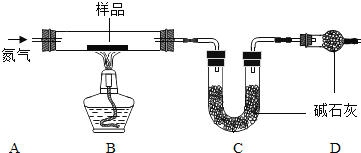
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水蒸气的总质量为______g,D装置中碱石灰的作用是______。
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______。
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3H2O的质量=______g。
②锈铁钉中FeCO3的质量=______g。
③锈铁钉中单质铁的质量分数=______。
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?______(填“有”或“无”),请通过计算说明_____。(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:Fe+Fe2(SO4)3=3FeSO4,Fe2(SO4)3的相对分子质量为400)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com