
 19、根据甲、乙、丙三种物质在水中的溶解度曲线和资料回答下列问题:
19、根据甲、乙、丙三种物质在水中的溶解度曲线和资料回答下列问题:| 溶解度/g | 一般称为 |
| <0.01 | 难溶 |
| 0.01~1 | 微溶 |
| 1~10 | 可溶 |
| >10 | 易溶 |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
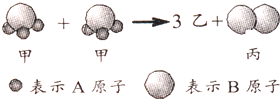 请你根据如图所示回答下列问题:
请你根据如图所示回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | 3 | 1 | 34 |
| 反应后质量/g | X(未知) | 28 | 1 | 14 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
| 加入酚酞溶液 | 溶液变红 | 现象Ⅰ | 溶液变红 |
| 加入CuSO4溶液 | 产生气泡和蓝色沉淀 | 现象Ⅱ | 产生气泡和蓝色沉淀 |
| 加入CaCl2溶液 | 无明显变化 | 无明显变化 | 产生白色沉淀 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
| 实验操作 | 实验现象 | 实验结论 |
①取少量滤液于试管中,加入过量CaCl2溶液 ②过滤,向滤液中滴加CuSO4溶液 ①取少量滤液于试管中,加入过量CaCl2溶液 ②过滤,向滤液中滴加CuSO4溶液 |
①有白色沉淀生成 ②只产生蓝色沉淀,无气泡 ①有白色沉淀生成 ②只产生蓝色沉淀,无气泡 |
滤液中的溶质是Na2CO3和NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:
请你根据下图所示回答下列问题:
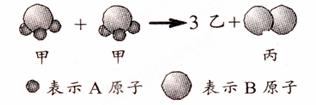
(1)甲、乙、丙三种微粒构成的纯净物中,有 ▲ 种是化合物。
(2)该化学反应中,甲、丙两种粒子的个数比是 ▲ 。
(3)该反应的属于基本反应类型的 ▲ 反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com