
����Ŀ��С������H2O2��Һ��O2��ʵ��̽����������й��̣��ش��й����⡣
��1��MnO2����������5mL5%��H2O2��Һ�м�������MnO2�����������������ݡ�

��д����H2O2��Һ�Ʊ�O2�Ļ�ѧ����ʽ��____________________________________��
����������Ӧԭ���Ʊ����ռ�һƿ�����O2��������װ��ͼ��ѡ����װһ��װ�ã�������˳��Ϊ_______�� __________�� ________�����ţ���Ϊ��ȷ��ʵ��ɹ�����װҩƷ֮ǰӦ��_________��
�ۼ���O2�ķ�����___________________________ ����ľ����ȼ����֤���ռ�������ΪO2��
��2��FeCl3��Һ������
��5mL5%��H2O2��Һ�м���2��һ��Ũ�ȵ� FeCl3��Һ�����������������ݡ�
����֪��FeCl3��Һ����Ҫ������������H2O��Fe3+��Cl-
�����⣩��������H2O2��Һ�ķֽ�������ã�
�����裩����һ��������H2O
�������������Fe3+
��������������Cl-
���������ټ���һ�����ܳ�����������__________________________________________��
��ʵ�飩
���� | ���� |
�����������䣬��H2O2��Һ�м���NaCl��Һ | �����Ա仯 |
�����������䣬��H2O2��Һ�м���Na2SO4��Һ | �����Ա仯 |
�����������䣬��H2O2��Һ�м���Fe2(SO4)3��Һ | ���������������� |
�����ۣ��ڼ���___������������һ����һ�ּ��費������
�۴����Ƚϴ�ѭ�����õĽǶȷ�����_____���ѧʽ�����ʺ����÷�Ӧ�Ĵ�����
���𰸡� 2H2O2![]() 2H2O + O2�� B C E ���װ�������� �������ǵ�ľ�������ڼ���ƿ�� ����������Һ���ܼ���ˮ �� MnO2
2H2O + O2�� B C E ���װ�������� �������ǵ�ľ�������ڼ���ƿ�� ����������Һ���ܼ���ˮ �� MnO2
�����������⿼�����������ȡװ�ú��ռ�װ�õ�ѡ�������ļ��飬�����õ�̽�������������ȡװ�õ�ѡ���뷴Ӧ���״̬�ͷ�Ӧ�������йأ�������ռ�װ�õ�ѡ����������ܶȺ��ܽ����й����ڴ����õ�̽��ʱ�����ÿ��Ʊ�����ԭ����
��1���ٹ��������ڶ������̵Ĵ������·ֽ�Ϊˮ����������ѧ����ʽ��2H2O2 ![]() 2H2O + O2��������H2O2��Һ�Ʊ�O2ʱ���ǹ�����Һ���ϲ�����ȣ���ѡ��ķ���װ����B���Ƶ������к���ˮ������Ũ���������ˮ�ԣ�����װ��Ũ�����ϴ��ƿ��ȥˮ�����������ܶȴ��ڿ��������������ſ������ռ����Ʊ����ռ�һƿ�����O2��������װ��ͼ��ѡ����װһ��װ�ã�������˳��ΪB��C��E��Ϊ��ȷ��ʵ��ɹ�����װҩƷ֮ǰӦ�ü��װ�������ԣ�
2H2O + O2��������H2O2��Һ�Ʊ�O2ʱ���ǹ�����Һ���ϲ�����ȣ���ѡ��ķ���װ����B���Ƶ������к���ˮ������Ũ���������ˮ�ԣ�����װ��Ũ�����ϴ��ƿ��ȥˮ�����������ܶȴ��ڿ��������������ſ������ռ����Ʊ����ռ�һƿ�����O2��������װ��ͼ��ѡ����װһ��װ�ã�������˳��ΪB��C��E��Ϊ��ȷ��ʵ��ɹ�����װҩƷ֮ǰӦ�ü��װ�������ԣ�
������������ȼ�ԣ���ʹ�����ǵ�ľ����ȼ������O2�ķ����ǽ������ǵ�ľ�������ڼ���ƿ�ڣ���ľ����ȼ����֤���ռ�������ΪO2��
��2���ټ���һ�����ܳ����������ǹ���������Һ���ܼ���ˮ��
�������������䣬��H2O2��Һ�м���NaCl��Һ�������Ա仯��˵��Cl-��H2O2��Һ�ķֽⲻ������ã������������䣬��H2O2��Һ�м���Fe2(SO4)3��Һ�����������������ݣ�FeCl3��Һ��Fe2(SO4)3��Һ������Fe3+��˵��Fe3+��H2O2��Һ�ķֽ�������ã������������
��MnO2������ˮ���������գ������Ƚϴ�ѭ�����õĽǶȷ�����MnO2���ʺ����÷�Ӧ�Ĵ�����


 ��ڽ��ȫ������ϵ�д�
��ڽ��ȫ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼����������һ�������·�Ӧ������һ����Ҫ�Ļ���ԭ�ϼ״���CO2+3H2![]() CH3OH+H2O�������йظ÷�Ӧ��˵����ȷ����( )
CH3OH+H2O�������йظ÷�Ӧ��˵����ȷ����( )
A. ΪCO2�����ô�����һ����;�� B. ��-좸�����������ڷ�Ӧǰ�����˱仯
C. ��ԭ�����ڷ�Ӧǰ�����˸ı� D. ���ڸ��ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ϢϢ��أ�������ѧ֪ʶ�ش���������:
(1)����G�����ϻ��������ɫ��Ⱦ�������ϲ�����_____(��ѡ��)��
A.�л���B.�ϳɲ���C.������
(2)��ʹӲˮ�����ķ�����________ (��ѡ��)��
A.��������B.�������̿C.���
(3)����Ʒ����Ϳһ�������ܷ���ʴ����ԭ������ֹ������________�Ӵ���
(4)̼������������θ�����֢��һ��ҩ�����������ᷴӦ�Ļ�ѧ����ʽΪ________��
(5)ҽ��������ˮ�к���һ�����������ӣ������Cl-�����ӽṹʾ��ͼ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������CaCl2�Ļ����Һ����������ε���Na2CO3��Һ�����ɳ������������Na2CO3��Һ�����ı仯��ϵ����ͼ��ʾ������˵���������
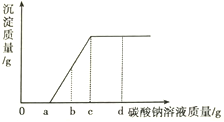
A. �μ�̼������Һ����Ϊa��c��ʱ����Һ�з����ķ�ӦΪCaCl2+Na2CO3=2NaCl+CaCO3��
B. �μ�̼������Һ������b��ʱ����Һ�к�����������
C. �μ�̼������Һ������a��ʱ����Һ������ԭ�����Һ������
D. �μ�̼������Һ������c��ʱ����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����һ����Ҫ�Ļ���ԭ�ϡ�����Ȼ�����Һ���Ƶ��������������ƺ���������Ӧ�Ļ�ѧ����ʽΪ2NaCl+2H2O![]() Cl2��+H2��+2NaOH����ȡһ���������Ȼ�����Һ���е�⣬���Ȼ�����ȫ��Ӧʱ���õ�85.4g��Һ������������������ʱ��Ĺ�ϵ��ͼ��ʾ�������:
Cl2��+H2��+2NaOH����ȡһ���������Ȼ�����Һ���е�⣬���Ȼ�����ȫ��Ӧʱ���õ�85.4g��Һ������������������ʱ��Ĺ�ϵ��ͼ��ʾ�������:

(1)�Ȼ�����ȫ��Ӧʱ����������������_________g��
(2)�Ȼ�����ȫ��Ӧʱ�������������Ƶ�������_________��?
(3)ԭ�Ȼ�����Һ�����ʵ�����������_________?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������̼����Ȳ����ڱ���NaHCO3��Һ��Ҳ����NaHCO3��Ӧ��ijѧ������Ũ���������ʯ��Ӧ��ȡ��������Ķ�����̼���壬ʵ�����ṩ������װ�ú�ҩƷ����ش�������⣺

(1)�����ٵ�������______�������ڵ�������_____��
(2)ʵ������ȡ������̼���巢��װ��Ӧѡ_____(�����)��ʵ������ȡ������̼����ķ�Ӧԭ��______(�û�ѧ����ʽ��ʾ)�����ø�װ��ʵ������������д��ʵ�����������Ļ�ѧ����ʽ______��
(3)��������װ��C��D������ʱ���������ӿ�˳��Ӧѡ______��
A��cdab B��abcd C��dcba D��badc
(4)����װ��E�ռ�������̼���壬������Ӧ��_____(��ӿ����)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ��������мס��ҡ��������������ʣ���һ�������³�ַ�Ӧ����÷�Ӧǰ������ʵ�����������ͼ��ʾ������˵����ȷ����
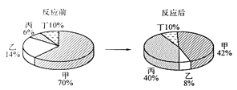
A. ��һ���ǵ��� B. �÷�Ӧһ���ǻ��Ϸ�Ӧ
C. ��Ӧ�мס��ҵ�������Ϊ5��1 D. ��һ���÷�Ӧ�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�������ʵ��С��ֱ�������ⶨNa2CO3��NaCl�������Na2CO3������ʵ�顣
(1)���飺����������
��һ�����Ļ�����ܽ��������CaCl2��Ȼ�����ó������ˡ�ϴ�ӡ���ɡ�������ȷ��CaCl2��Һ�Ƿ�����ķ�����________________��ϴ�ӳ������жϳ����Ƿ�ϴ���IJ�����_______________��
(2)���飺���������
��һ�����Ļ�������������ᷴӦ������ͼװ�òⶨ������CO2����������Ϊ��СCO2���ܽ⣬B����ҺӦ��_________________��ѡ�ø���Һ��ʵ�������Dz�ȷ��ԭ����_________________��

(3)�������һ����ס������������ͬ��ʵ�鷽�����ⶨ�������Na2CO3�ĺ�����
������_________________��
�õ�����Ҫ�Լ���_____________________(����2��)��
�õ��IJ���������_________________(����2��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ҹ��ڿƼ����Ļ��������ȷ��洴�·�չ��
I������������졢����ȡ���ش�ͻ��
2018��4��2�գ��칬һ��Ŀ�������Բ����ɸ������ش����㡣���־���ҹ����캽����ҵ��������ʱ����
(1)�����칬һ�Ŷ���Դ̫���ܵ�ص���Ҫ���ɲ��ϡ����ʹ�����ʯӢ(SiO2)������̼�ڸ��������·�Ӧ�Ƶõģ�ͬʱ����һ�ֿ�ȼ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ_____��
(2)�軹�Ǽ����оƬ�Ļ�����ϣ����䵼���Բ��ã������ʯ�ڵ����Է���Զ�����裬����������оƬ������ϵ����ѡ��
�ٴ�ԭ�ӽṹ�Ϸ��������ʯ(C)�������ƻ�ѧ���ʵ�ԭ����_____��
������Ȼ���ʯ��Դϡ�٣���������Ҫ�����Ǿ��ݽ��ʯ����ɺͽṹ�跨������ʯ����������������ʯ�ķ�����һ����ʯīΪԭ���ڸ��¸�ѹ�ʹ����������ºϳɣ������ڽϵ��¶Ⱥ�ѹ�����ü���(CH4)��Ϊԭ��������ʯ��Ĥ��
����˵������ȷ����_____(д��ĸ���)��
A��һ��Ԫ�ؿ�����ɶ������ʲ�ͬ�ĵ���
B��ʯī�ϳɽ��ʯ�������������仯
C��ʯī����ʯ�������ʲ�ͬ����Ϊ�ṹ��ͬ
D�����ʵ������ںܴ�̶��Ͼ��������ʵ���;��������Ψһ�ľ�������
�۲�������̼�������ƻ�ѧ���ʣ����������������Ͷ�����̼Ҳ�����ƻ�ѧ���ʡ���д����������������������Һ��Ӧ�Ļ�ѧ����ʽ_____��
���Ļ�����һ�����л����㴫ͳ�Ļ�
�Ŵ��ҹ�����ͻ�������������ʱ仯����ʶ������ĩ������Ĺ��չ��顶�����ǡ���������䳲����ķ�����������������(��ľ��)��������(���ǻ�)��ϼ�ˮ������Һ��ϴ��˿����������Һ��ϴ��˿����Ҫ����Ϊ����һ������_____(д��ѧʽ��ˮ����)��(ע����ľ�ҵ���Ҫ�ɷ�Ϊ̼��أ����ǻҵ���Ҫ�ɷ�Ϊ������)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com