
【题目】“低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”是在食盐中用NaCl按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
(1)测得某“低钠盐”样品a中只含有NaCl和KCl,该样品中的NaCl和KCl溶于
水时解离出的阴离子都是___________(填离子符号)。
(2)探究某“低钠盐”样品b中是否添加有镁盐,以及添加的是何种镁盐?
【猜想】I、不含镁盐 Ⅱ、含有硫酸镁 Ⅲ、含有氯化镁

【进行实验】
(3)请完成下表(已知BaSO4是难溶于水和酸的白色固体):
假设和现象 | 判断和化学方程式 | |
① | 若现象a为白色沉淀 | 则猜想____不成立。 |
② | 若现象a为_________, 现象b为_________。 | 则猜想Ⅲ成立。写出无色溶液B与硝酸中和反 应的化学方程式_________________。 |
③ | 若现象a、b均 为:产生白色沉淀 | 则猜想____成立。写出无色溶液B与硝酸钡溶液 反应的化学方程式______________。 |
【答案】 Cl— I 产生白色沉淀 无明显现象(或无白色沉淀) NaOH+HNO3=NaNO3+H2O Ⅱ Ba(NO3)2+Na2SO4=BaSO4↓+2 NaNO3
【解析】(1)NaCl由钠离子和氯离子构成,KCl由氯离子和钾离子构成,NaCl和KCl溶于水时解离出的阴离子都是氯离子;镁离子和氢氧根离子结合生成氢氧化镁沉淀,所以加入氢氧化钠时,如果出现白色沉淀,则证明有镁盐,则猜想I不成立;如若现象a为产生白色沉淀(证明含有镁盐),现象b为无明显现象(无硫酸根离子)则猜想Ⅲ成立。酸和碱生成盐和水的反应叫中和反应;无色溶液B与硝酸中和反应的化学方程式为:NaOH+HNO3=NaNO3+H2O;硫酸根离子和钡离子结合生成硫酸钡白色沉淀,若现象a、b均为:产生白色沉淀,说明有镁离子和硫酸根离子,即含有硫酸镁;则猜想Ⅱ成立;硫酸镁和氢氧化钠反应生成氢氧化镁沉淀和硫酸钠,无色溶液B与硝酸钡溶液反应的化学方程式Ba(NO3)2+Na2SO4=BaSO4↓+2 NaNO3。


科目:初中化学 来源: 题型:
【题目】对于下列几种化学符号,有关说法正确的是
①H ②Fe2+ ③Cu ④P2O5 ⑤Fe3+ ⑥NaCl
A.能表示一个分子的是④⑥
B.表示物质组成的化学式是③④⑥
C.②⑤的质子数相同,化学性质也相同
D.④中的数字“5”表示五氧化二磷中有5个氧原子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学通过氯酸钾制取氧气,相关数据如表:
反应前物质的总质量/g | 反应后剩余物的总质量/g |
25 | 15.4 |
请计算:
(1)该同学制得氧气的质量为_______g。
(2)参加反应的氯酸钾的质量____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过下列图示实验得出的结论中正确的是( )

A.图1所示实验既说明甲烷具有可燃性,又说明甲烷中含有碳、氢两种元素
B.图2所示实验既说明二氧化碳密度比空气大,又说明二氧化碳不能燃烧也不支持燃烧
C.图3所示实验既说明电解水生成氢气和氧气,又说明水是由氢气和氧气组成的
D.图4所示实验既可探究可燃物的燃烧条件,又说明红磷不是可燃物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高铁是中国技术创新的典范,是中国人用自己的方式建设的运输网络,是一种值得大力推广的绿色运输方式。
(1)修建铁路所需大量钢铁是以铁矿石为主要原料冶炼而得。写出用一氧化碳和赤铁矿炼铁的化学方程式_______________________;
(2)高铁列车车厢是密闭的空间,因此提供清洁的空气、保持车厢的卫生非常重要。高铁酸钠(Na2FeO4)是高铁常用的一种“绿色环保高效”消毒剂,高铁酸钠中铁元素的化合价是____;制备高铁酸钠的反应式:Fe2O3+3NaNO3+4NaOH=2Na2FeO4+3NaNO2+2X, X的化学式为_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小华同学在用稀盐酸和氢氧化钠溶液进行中和反应实验时,测得反应过程中溶液的酸碱度变化如下图所示。
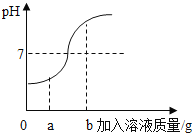
(1)该实验是将 (选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入的溶液质量为a克时,向其所得溶液中加入碳酸钠溶液,可观察到的现象为 。
(3)当加入溶液的质量为b克时,所得溶液中溶质为 (写化学式)。
(4)现有50g溶质质量分数为7.3%的稀盐酸溶液,则需要多少质量溶质质量分数为4%的氢氧化钠溶液才能恰好中和?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com