


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:初中化学 来源: 题型:阅读理解
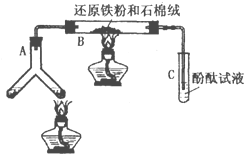 某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:
某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:| N2和H2的体积比 | 5:1 | 3:1 | 1:1 | 1:3 | 1:5 |
| 酚酞变红所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源:2012-2013学年广东省佛山市南海区九年级(上)期末化学试卷(解析版) 题型:解答题
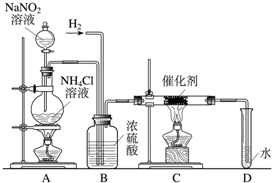
 2NH3该反应属于基本反应类型中的______反应.
2NH3该反应属于基本反应类型中的______反应.| 性质 名称 | 颜色、气味 | 熔点(℃) | 沸点(℃) | 25℃水中溶解度(g/L) | 标况下密度 (g/L) |
| NH3 | 无色、刺激性 | -77.7 | -33 | 456 | 0.6942 |
| H2 | 无色、无味 | -259.2 | -253 | 0.0015 | 0.0899 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com