
����Ŀ�������װ�г�ʹ��һ�ִ�װ��������Ʒ��Ϊ��504˫�����������ǩ��ͼ��ʾ��ͬѧ�Ƕ�һ�����õ���504˫������������Ʒ�ܺ��棬���ʵ�����̽����

��������⣩���ù���ijɷ���ʲô��
���������ϣ������Ȼ�����Һ�ڳ����·�����Ӧ�����Ȼ�������
���������룩���ù����п��ܺ���Fe��Fe2O3��CaO��Ca��OH��2��CaCO3��
��ʵ��̽��1����ͬѧ�ķ�����
ʵ����� | ʵ������ | ʵ����� |
��1��ȡ�����������Թ��У��ܽ⣬���ú�ȡ�ϲ���Һ�μ���ɫ��̪��Һ | �����ܽ�ʱ�Թ���ڷ��̣��Թܵײ��в������Һ��� | ������һ����_____���������� |
��2����ȡ�����������Թ��У��μ�������_____ | ��������ʧ���д�����ɫ����������õ�dz��ɫ��Һ | ������һ������______,һ������Fe2O3 |
��3�������裨2���в���������ͨ�뵽�����ʯ��ˮ�� | _______ | ������һ������CaCO3 |
��ʵ�����ɣ�
��1����ͬѧ��Ϊ��ͬѧ��ʵ���в��ܵó�һ����Ca��OH��2�Ľ��ۣ�������_________��
��2����ͬѧ��Ϊ��ͬѧ��ʵ�鲢���ܵó�һ������FeO3�Ľ��ۣ�������_________��
��ʵ��̽��2���ҡ���ͬѧ�������ʵ�鷽��������֤��
��1���ҡ���ͬѧʵ�������ܵó�������Ʒ��һ��������_______������һ�����ʲ���ȷ������������_______��
��2���ҡ���ͬѧ�־���ʵ��������3.9g���������к������ʵ�������Ϊ2.3g������B��CaCO3������Ϊ1.0g������C������Ϊ2.0g��
��ʵ����ۣ��ۺ�����ʵ�鼰�������ݣ�
��1���жϾ��ù���ijɷ���_______��
��2�������������������������Ƶ�����������Ϊ______�ˡ�
���𰸡������ƣ� ϡ�����ϡ��� ���� ����ʯ��ˮ����ǣ� ֻ��������Ҳ�������ͬ���� �����������ᷴӦ�����Ȼ����������Ȼ�����Ӧ�����Ȼ���������ҺҲ��dz��ɫ�� �������� �������ƣ� Fe��Fe2O3��CaO��Ca (OH) 2��CaCO3 0.56
��������
[ʵ��̽��1]
��1�������ܽ�ʱ�Թ���ڷ��̣��������ܽ���ȣ���������ƣ�
��2����������Ӧ������Ϊ����������ʧ���д�����ɫ������������ϡ�����ϡ�������
��3���ɽ���֪��������һ������CaCO3����������ᷴӦ���ɶ�����̼��ͨ�����ʯ��ˮ���а�ɫ�����������������ʯ��ˮ����ǣ�
[ʵ������[
��1��������������ˮ������������ˮ���������������ƣ���������ֻ�������ƣ������������ƣ�Ҳ����ֹ����ܽ�ʱ�Թ���ڷ��̣��Թܵײ��в������Һ���������ֻ��������Ҳ�������ͬ����
��2�������������ᷴӦ�����Ȼ����������Ȼ�����Ӧ�����Ȼ���������ҺҲ��dz��ɫ����������������ᷴӦ�����Ȼ����������Ȼ�����Ӧ�����Ȼ���������ҺҲ��dz��ɫ��
[ʵ��̽��2]
��1�����ұ�ͬѧ����Ʒ�����֪���������������ۣ���������ˮ����ҺA�е��������ƺ�̼���Ʒ�Ӧ����̼��ư�ɫ�������������ơ�������B��̽����ȡ����B���Թ��У���������ϡ���ᣬ������ð������Һ��Ϊ��ɫ��˵��һ������̼��ƺ���������̼��������ᷴӦ�������ݣ������������ᷴӦ�����Ȼ�������ˮ�ʻ�ɫ�������������
���ұ�ͬѧ��ʵ�黹����ȷ��һ�������������ƣ���Ϊ��������ˮ��ӦҲ�������������ơ�����������ƣ�
��2������ʵ�����������������к������ʵ�������Ϊ2.3g��������B��CaCO3������Ϊ1.0g������C������Ϊ2.0g������Ԫ��������: ![]() ��1.2g<2.3g��
��1.2g<2.3g��
���һ�����������ƣ������ù���ijɷ���: Fe��Fe2O3��CaO��Ca (OH) 2��CaCO3��
(2)����������������Ƶ�����Ϊx.���ݸ�Ԫ�ص������غ��֪������������CaO��Ca (OH) 2�и�Ԫ�ص�����֮��������C�и�Ԫ�ص�������ȡ�����![]() ���: x=0.56g�����0.56��
���: x=0.56g�����0.56��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ����ʽ�ش��������⣺
��1�����������ڿ����б���__________________________��
��2��ϡ�����ˮ������Ҫ�ɷ�ΪCaCO3��_____________________��
��3���ú�����������ҩ������θ�����_______________________��
��4������ʯ������ʯ��_______________________________��
��5����Ȼ��������ȼ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ڰ�ɫ��ΰ�16�Ŀ�Ѩ�У��ֱ�μ�2����ɫʯ����Һ��
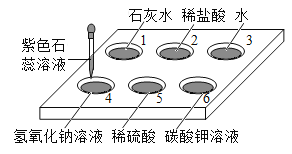
��1����Ѩ6����Һ��Ϊ��ɫ��˵��̼�����Һ��____________������ԡ����ԡ�����
��2����Һ��Ϊ��ɫ�Ŀ�Ѩ��________________�����Ѩ��ţ���ͬ����
��3����Ϊ�հ���ʵ��Ŀ�Ѩ��___________��
��4����������к�ʵ��ʱ���������������ʵ���������ͼʾ�����У��������___________������ţ���
a.ϡ��Ũ���� b.�㵹����������Һ
b.�㵹����������Һ c.�μӷ�̪��Һ
c.�μӷ�̪��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(C4H9Li)���ϳɹ�ҵ��һ�ֳ��õİ�ɫ��ĩ�Լ����۵㩁95�棬�е�80�棬��ˮ������������ȼ����Է�֮������64�����й��ڶ���﮵�˵����ȷ����( )
A. ���������4��̼ԭ�ӡ�9����ԭ�ӡ�1���ԭ�ӹ��ɵ�
B. �������̼Ԫ����������Ϊ75%
C. ����������ʹ�ù������������ȼ�գ�������ˮ����
D. ��������л��߷��Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��Ca��OH��2��Na2CO3��Һ����ȡNaOH����ַ�Ӧ����ˣ��õ���������Һ��������Һ�ijɷֽ���̽����
[�������]����Һ�����ʵijɷ���ʲô��
[���������]������һ��NaOH��Na2CO3
�������NaOH
��������______��������������������
[��Ʋ�ʵ��]���Կ��ܴ��ڵ����ʣ����һ��ʵ����֤��
ʵ����� | ʵ����� | ʵ������ | ʵ����� |
ʵ��һ | ȡ������Һ���Թ��У������м������ϡ���� | �����ݲ��� | ����_____������ |
ʵ��� | ��ȡ������Һ���Թ��У������е�������̼������Һ | _____ | ������������������Ӧ�Ļ�ѧ����ʽΪ______ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��С���ͬѧ�����ʵ��̽��ͭ�����������ֽ����Ļ��˳��:
[�ṩ��ҩƷ]��Ƭ��ͭƬ����Ƭ��ϡ���ᡢ�Ȼ�þ��Һ������п��Һ������ͭ��Һ����������Һ
[��������]��һ��:ͨ��4��ʵ�飬���Եó�����;
�ڶ���:ͨ��3��ʵ�飬���Եó�����;
������:ͨ��2��ʵ�飬���Եó�����;
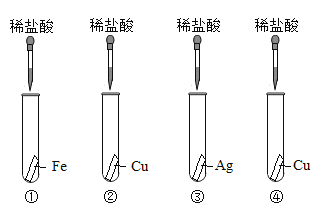
��ͼ�ǵ�һ��ͬѧ��Ʋ�������4��ʵ��
[ʵ�鷽��]
��С��ʵ����� | �йصĻ�ѧ����ʽ | ʵ����� |
��һ��:������ͼ��4��ʵ�飬�ڢܸ�ʵ���е�X��Һ��_______�� | �ڢ٢ڢ�ʵ����,ѡдһ��������Ӧ�Ļ�ѧ����ʽ________�� | ���ֽ����Ļ��˳����ǿ��������Ϊ_______�� |
�ڶ���:������ͼ�е�3��ʵ��,������_____(����ͼ��ʵ�����) | ||
������:����2��ʵ�飬�ֱ�д������ʵ��ķ�Ӧ��________�� | ѡдһ��������Ӧ�Ļ�ѧ����ʽ_______�� |
[��佻��]����С���ͬѧͨ���������ۣ����������ʾ���ջ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������У���ᷢ������ѧ������������
(1)ϴ�ྫ��������ۣ�������������_____���á�
(2)�Ϻ������ڰ�װ����ֱ��ˮ����������������̿+���˲�+����������ˮ���ա�����̿�ڴ���_____���ã��������ˮ����_____��ѡ���������������������������
(3) ��ũҵ�����У�ʩ�õIJ�ľ�ң���Ч�ɷ�ΪK2CO3������_____�ʡ�
(4)�ں�������þ������ͭ�Ĺ�ҵ��ˮ�м��������п�ۣ���ַ�Ӧ����ˣ����ù����ǣ���д��ѧʽ��_____��
(5)��ѧΪ��������ѩ����̿�����ҽ������������ء���ٵ���Ŀ���˶�Ա�ڱ���ǰ���ð�ɫ����þ�������֣�������Ϊ��þ�������ᡢ��ˮ�Ժã�������������
��þ��������Ч�ɷ��Ǽ�ʽ̼��þ��������ȼ��300�����ֽ⣬��ֽ�Ļ�ѧ����ʽ�ǣ�
Mg5(OH)2(CO3)4��5MgO+X+4CO2��,��X�Ļ�ѧʽ��_____��������Щ��Ϣ�������ƶϳ���þ��������һ����;��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ˮ��ɹ�ɵô��Ρ����γ�NaCl�⣬������MgCl2��CaCl2�Լ���ɳ�����ʡ�Ϊ����Ч�������ᴿ��ʵ��ĸ���������������ͼ��ʾ��
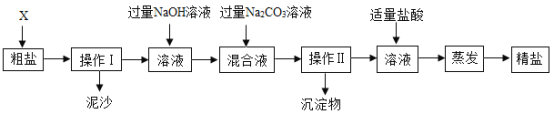
����������Ϣ�ش�
(1)����ɲ�����֮ǰ����������X������_____��
(2)�������Ͳ�������������______��
(3)��ʵ������м��������NaOH��Һ����ʵ��Ŀ����______���йػ�ѧ����ʽ��______��
(4)�жϼ�����������������ķ�����______��
(5)ʵ�����þ��ε��������ڴ�����NaCl��������ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����±���Ӧ���¶��£���4ֻʢ��100gˮ���ձ��У��ֱ����40 g KCl���壬����ܽ⡣KCl���ܽ����������ͼ
�ձ���� | �� | �� | �� | �� | �� |
�¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 |
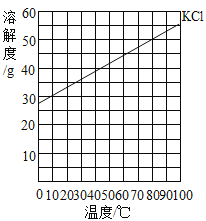
���й��ڢ١���������Һ��˵������ȷ���ǣ���
A.���������٣���
B.����Һͨ�����»�䱥����Һ
C.��������������=��=��
D.�����������ܼ���������Ϊ 2:5
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com