
| A. | 用肥皂水区分硬水和软水 | |
| B. | 洗洁精可乳化餐具上的油污 | |
| C. | 厨房中煤气管道漏气,立即开灯检查 | |
| D. | 用氢氧化钙溶液中和酸性土壤 |
分析 A、硬水与软水因含钙镁离子化合物的量不同,所以可用肥皂水来区分.
B、洗洁精、洗衣粉等这样的能使乳浊液变成稳定的混合物的物质称为乳化剂,乳化剂所起的作用称为乳化作用.
C、根据可燃性的气体与空气混合点燃易发生爆炸判断.
D、根据农作物适宜生长在中性土壤中,酸性土壤不适宜作物生长,需要加碱中和进行分析.
解答 解:A、加肥皂水时,硬水没有泡沫,而软水有泡沫.故A做法合理.
B、洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,故B做法合理.
C、煤气是可燃性的气体与空气混合遇明火易发生爆炸,故C做法不合理.
D、氢氧化钙属于碱,可以中和酸性土壤中的酸,改良酸性土壤,故D做法合理.
故选:C.
点评 生活中处处有化学,物质的性质决定物质的用途,掌握硬水与软水的区别、乳化作用、碱的性质等即可正确解答本题.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | HCl CuSO4 KNO3 Na2SO4 | B. | FeCl3 HCl NaCl NaOH | ||
| C. | CaCl2 K2CO3 HCl (NH4)2CO3 | D. | NaNO3 Na2SO4 HCl H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气是一种化学性质较活泼的气体单质,一定条件下,能与某些金属单质、某些非金属单质、某些化合物发生剧烈的氧化反应 | |
| B. | C、H2、CO三种物质不仅具有可燃性,而且还具有还原性,在一定条件下,能从一些金属氧化物中还原出金属单质 | |
| C. | 碳元素组成的单质有:金刚石、石墨、C60等;磷元素组成的单质有:红磷、白磷.由于都是同一元素组成的多种单质,因此,它们的化学性质相同 | |
| D. | 纯碱、烧碱、氢氧化钾溶液的pH>7,但纯碱不是碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
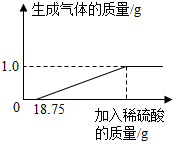 某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.计算所用硫酸的质量(Fe+H2SO4=FeSO4+H2↑)
某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.计算所用硫酸的质量(Fe+H2SO4=FeSO4+H2↑)查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 白菜上喷洒甲醛溶液以使白菜保鲜 | |
| B. | 误食重金属盐后,可尽快喝适量牛奶或鸡蛋清解毒 | |
| C. | 铵态氮肥和草木灰(含K2CO3)不能混合使用 | |
| D. | 加油站严禁吸烟 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4 AgNO3 NaCl | B. | CaCl2 K2CO3 NaNO3 | ||
| C. | CuSO4 NaCl KNO3 | D. | H2SO4 NaCl Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com