
【题目】向200.0 g AgNO3溶液中加入Fe和Cu的混合粉末X g,搅拌,充分反应后过滤、洗涤、干燥得32.4 g固体。向滤液中滴加NaCl溶液,产生白色沉淀。下列说法正确的是
A.干燥所得固体中加入稀盐酸有气体生成B.混合粉末的质量范围是8.4<X<9.6
C.滤液的质量一定大于167.6 gD.原AgNO3溶液的溶质质量分数是25.5%
【答案】BC
【解析】
向硝酸银溶液中加入铁和铜的混合粉末,铁先与硝酸银反应生成硝酸亚铁和银,待铁完全反应后,铜再与硝酸银反应生成硝酸铜和银,充分反应后过滤、洗涤、干燥,向滤液中滴加NaCl溶液,产生白色沉淀,氯化钠能与硝酸银反应生成氯化银白色沉淀,说明滤液中硝酸银过量,说明铁、铜已经完全反应,故所得的32.4g固体为银。
A、由分析可知,铁、铜已经完全反应,铁与硝酸银反应生成硝酸亚铁和银,铜与硝酸银反应生成硝酸铜和银,故所得固体为银,在金属活动性顺序里,银位于氢之后,不与稀盐酸反应,不会有气泡生成,不符合题意;
B、由分析可知,充分反应后过滤、洗涤、干燥,所得的固体为银,如果混合固体全部是铁,设铁的质量为a

![]() a=8.4g
a=8.4g
如果混合固体全部是铜,设铜的质量为b

![]() b=9.6g
b=9.6g
该混合固体为铜、铁的混合物,故混合粉末的质量范围是8.4<X<9.6,符合题意;
C、根据质量守恒定律,化学反应前后,物质的总质量不变,向200.0 g AgNO3溶液中加入Fe和Cu的混合粉末X g,![]() 、
、![]() ,硝酸银溶液的质量+混合粉末质量X=滤液的质量+反应后固体的质量,故200g+Xg=滤液的质量+32.4g,滤液的质量=167.6g+Xg,故滤液的质量一定大于167.6 g,符合题意;
,硝酸银溶液的质量+混合粉末质量X=滤液的质量+反应后固体的质量,故200g+Xg=滤液的质量+32.4g,滤液的质量=167.6g+Xg,故滤液的质量一定大于167.6 g,符合题意;
D、硝酸银溶液的质量已知,但是硝酸银过量,无法求出硝酸银溶液中溶质的质量,即无法求出硝酸银溶液的溶质质量分数,不符合题意。
故选BC。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:初中化学 来源: 题型:
【题目】对物质进行归纳、分类,是学习化学的重要方法。
如图是一位同学整理的有关CO2的知识网络图。
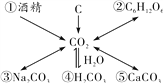
物质①的化学式是____________;
物质②的组成元素有________种;
物质③中的阳离子符号是________;
写出CO2转化为物质④的化学方程式__________________________________;
物质⑤中碳元素的化合价是________价。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“碧螺春”茶叶中的单宁酸具有抑制血压上升、清热解毒、抗癌等功效,其化学式为C76H52O46,下列说法错误的是
A. 单宁酸由碳、氢、氧三种元素组成
B. 一个单宁酸分子是由76个碳原子、52个氢原子和46个氧原子构成
C. 单宁酸中碳、氧元素的质量比为38:23
D. 单宁酸中氢元素的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小宇同学对上题实验进行了改进,方案如下:
将过量的白磷放入容积为40mL的试管中,用橡胶塞塞紧试管,通过导管与实际容积为60mL且润滑性很好的注射器连接,如图所示(白磷所占体积忽略不计)。

(1)实验前,打开弹簧夹,将注射器活塞的前沿从30mL刻度处推至20mL刻度处,松手后若活塞仍能返回至______mL刻度处,则说明_________。
(2)夹紧弹簧夹,加热白磷使其充分反应,试管冷却后再松开弹簧夹,活塞向左移动,最终停留在________mL处。
(3)若不使用弹簧夹,加热白磷充分反应后冷却,可观察到活塞先向_____(选填“左”或“右”)移动,原因是______;最终活塞稳定在________mL处。
(4)若按小宇的设想进行实验,实际可能遇到诸多问题而发生危险,造成实验失败。例如:______。
(5)小瑞同学也对上题实验进行了改进,将红磷替换成了蜡烛进行测定空气中氧气体积分数的实验。他认为蜡烛更环保,而且取用方便。请评价小瑞改进实验的可行性和准确性。
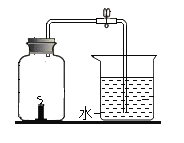
可行性评估:____________;准确性评估:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“中国制造”“一带一路”等基础建设都需要用到大量钢铁。
(1)认识铁及其应用
①从微观角度看,铁是由____(填化学符号)构成,其在地壳中的含量居所有元素第____位。
②生铁和钢均是生活中常见的金属材料,它们都属于 __(填“纯净物”或“混合物”)。
③铁锅可用以烹饪,利用了铁的_____性。很多人认为:铁锅炒菜过程中会有少量铁进入人体,与胃液中的盐酸反应,请写出铁与稀盐酸反应的化学方程式_____,该反应的基本反应类型为_____,所以用铁锅炒菜能“补铁”,这里的“铁”指______(填“原子”“单质”或“元素”)。
(2)铁的冶炼
某化学实验小组利用下图装置模拟铁的冶炼并测定某赤铁矿石中氧化铁的质量分数(假设赤铁矿中杂质不参与反应)。
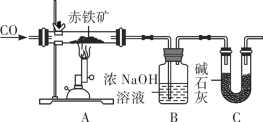
①实验开始时,先进行的操作是____(填字母)。
a 通入一氧化碳 b 加热
②实验过程中观察到装置A中玻璃管内发生的现象是______。
③写出B装置发生反应的化学方程式是__________。
④从环境保护的角度看此实验存在的缺陷是__________。
⑤实验前称量赤铁矿石的质量为20g,通入足量一氧化碳充分反应,测得B装置总质量增加13.2 g。若不考虑实验过程中水分带出的影响,则装置C的作用是________;求该赤铁矿石中氧化铁的质量分数______(请写出计算过程)。
(3)铁的防护
①铁制品暴露于潮湿的空气中,易形成铁锈。由于铁锈结构特点是______,故铁制品表面的铁锈应及时清除,用稀盐酸适时浸泡是清除铁锈的方法之一,铁锈的主要成分与盐酸反应的化学方程式为_________。
②家庭使用的铁锅防锈方法有___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过学习,我们已经了解了常见金属在溶液中的活动性顺序。铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
(提出假设)
(1)对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.________________
(查阅资料)该研究小组必须查阅的资料是_________(填序号)
①Cr、Al、Cu三种金属的密度②Cr能否与酸反应③Cr、Al、Cu三种金属导电性
(设计实验)
同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如表:
金属 | Cr | Al | Cu |
与盐酸反应现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
(控制实验条件)
(2)打磨三种金属的目的____________;上述实验使用等浓度的盐酸溶液的理由是___________________。
(得出结论)
(3)原假设中正确的是_______(填假设中“a”“b”或“c”).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式:___________。
(结论应用)
(4)根据探究结果,写出Al丝与CuSO4溶液反应的化学方程式_______________,并写出反应的实验现象___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钨(W)是当代高科技新材料的重要组成部分。工业上冶炼钨的主要反应原理如下:
①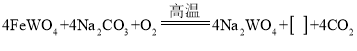
②![]()
③![]()
④![]()
下列说法不正确的是( )
A.反应①④中有元素的化合价发生改变
B.反应①②③④的产物都有氧化物
C.反应③属于分解反应
D.①中空格中应填入2Fe2O3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某氯化钠和氯化铜混合溶液中氯化铜的质量分数,兴趣小组的同学们进行如下实验:
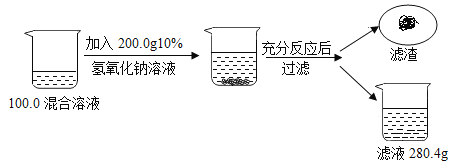
(1) NaOH由 种元素组成;
(2) NaOH的相对分子质量是 。
(3) NaOH中氧元素的质量分数为 %;
(4)滤渣的质量为 g;
(5)计算原混合溶液中氯化铜的质量分数。(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com