
胆矾(CuSO4·5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4·5H2O的新工艺.模拟制备装置如下图所示,根据题意回答下列问题.

(1)如图装置中,分液漏斗内装的液体是________(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO2+2NaOH![]() 2NaNO2(该物质化学名是________)+H2O.该装置中搅拌器的作用是________.反应所得产品在________(填“三颈烧瓶”或“锥形瓶”)中.
2NaNO2(该物质化学名是________)+H2O.该装置中搅拌器的作用是________.反应所得产品在________(填“三颈烧瓶”或“锥形瓶”)中.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中常常含有的杂质是一种硝酸盐,其化学式是________,已知10℃、20℃时有关物质的溶解度为:CuSO4·5H2O(17.4 g、20.7 g);该硝酸盐(95.3 g、125.1 g),提纯CuSO4·5H2O的实验操作是________.
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是________,检验该气体的实验操作是________.
(4)将0.80 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.

①由图中可以看出,CuSO4·5H2O分解的最低温度是________.
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4·5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为________.
答案:(1)浓硝酸 亚硝酸钠 充分接触,加快反应速度 三颈烧瓶
(2)Cu(NO3)2 重结晶(或冷却结晶);
(3)铜离子作催化剂,双氧水分解出氧气;用带火星木条检验,看是否复燃.
(4)①102℃; ②CuSO4˙H2O;③CuSO4˙5H2O
CuO+SO3↑+5H2O↑; △
| ||
| 250 |
| 160+18x |
| 0.800g |
| 0.570g |
| ||


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省泰州市九年级下学期第二次涂卡训练化学试卷(解析版) 题型:简答题
某化学兴趣小组提出可以用含铜废料制备蓝色胆矾(CuSO4·XH2O)。
查阅资料:
Ⅰ 过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2)都会促进其分解。
Ⅱ CuSO4·XH2O易溶于水难溶于酒精,加热时会逐步失去结晶水,最终生成CuSO4。
Ⅲ 白色粉末CuSO4易与水化合生成CuSO4·XH2O
I、硫酸铜晶体的制备
方案1:毛毛同学根据已学知识,提出了制备硫酸铜方案:
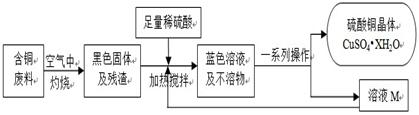
方案2:方舟同学查阅资料归纳了一种工业制备硫酸铜的流程:

(1)上述方案1中加热搅拌的作用是 ,形成蓝色溶液的化学反应方程式是: 。
(2)方案2中,加入H2O2后要求温度控制在50℃到60℃是为了防止 。
(3)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(4)方案中“一系列操作”依次为:过滤、、冷却结晶、(填序号)。
A.蒸发浓缩 B.加水稀释 C.加水溶解 D.过滤
(5)溶液M、N都是CuSO4的 (选填“饱和”、“不饱和”或“不一定饱和”)溶液,向其中加入无水CuSO4,均会析出硫酸铜晶体,这是因为 。
⑹所得硫酸铜晶体需要洗涤后晾干,最合适的洗涤试剂是 。
A.冷蒸馏水 B. 95%的酒精 C.热蒸馏水
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
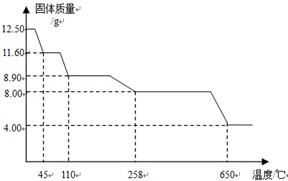
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行加热分解,获得相关数据,并绘制成固体质量一温度的关系图。
(7) 258℃时,固体完全变成白色粉末。根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程,3分)
(8)加热过程中,硫酸铜晶体分步失去结晶水。请写出45℃到110℃时反应方程式
(9) 580℃以上时,硫酸铜粉末就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省镇江市九年级5月中考模拟考试化学试卷(解析版) 题型:探究题
在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4·XH2O)。
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水。对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解。
(2)CuSO4·XH2O可溶于水,在加热时会生成CuSO4和H2O。
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
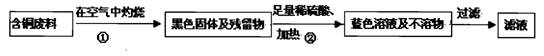
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:

(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是: 。
(2)从环保角度对两套方案的不同部分进行比较,你认为方案 (填1或2)更合理。理由是: 。
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为 。
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:
。
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体。晶体采用酒精淋洗的优点是 。
II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定
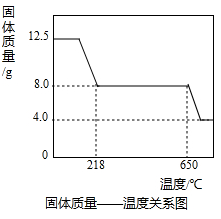
学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行热分解,获得相关数据,并绘制成固体质量一温度的关系如图。
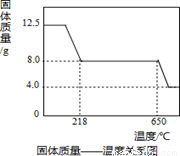
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为 色,最终变为黑色;
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为 ;
(3)根据图中数据,计算CuSO4·xH2O中x的值为 。(请写出计算过程)
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式: 。
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为 。碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3·Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为 ,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是 (填一种有机物名称)。
查看答案和解析>>
科目:初中化学 来源:江苏省模拟题 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com