(2007?宣武区二模)初中化学课学完以后,化学学习兴趣小组对“金属活动性顺序”从内容、规律以及应用等方面进行了总结.请你认真填写下面的空白内容:
(1)金属活动性顺序表:K Ca Na
Mg、Al、Zn、Fe、
Mg、Al、Zn、Fe、
Sn Pb (H) Cu Hg Ag Pt Au
(2)小华设计了三组物质比较锌和铜的金属活动性:①Zn、Cu、稀硫酸;②Zn、Cu、MgSO
4溶液;③Zn、Cu、AgNO
3溶液仅用组内物质就能够直接达到目的是
A
A
.
A.仅有①B.①③C.②③D.①②③
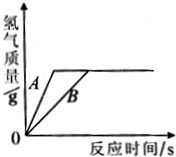
(3)用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如图所示.试回答:
①曲线A表示的是
锌
锌
(填“铁”或“锌”)跟稀硫酸反应的情况.
②上述曲线图除能说明①的结论外,还可得出的结论是(填一条)
产生氢气的质量相等,说明硫酸的量不足,铁和锌的量过量
产生氢气的质量相等,说明硫酸的量不足,铁和锌的量过量
.
(4)某学校的实验室的实验废液中含有大量的FeSO
4、CuSO
4,小明欲将从废液中回收铜和得到硫酸亚铁溶液.他应选用的试剂依次有
过量铁、适量硫酸
过量铁、适量硫酸
.(实验结束不再产生其他废液)






 名校课堂系列答案
名校课堂系列答案 (2007?宣武区二模)初中化学课学完以后,化学学习兴趣小组对“金属活动性顺序”从内容、规律以及应用等方面进行了总结.请你认真填写下面的空白内容:
(2007?宣武区二模)初中化学课学完以后,化学学习兴趣小组对“金属活动性顺序”从内容、规律以及应用等方面进行了总结.请你认真填写下面的空白内容: