
【题目】工业上用氨碱法制纯碱,制取过程如下:
![]()
(1)上图中①是_____。
(2)上述制取过程中的化学反应原理(用化学方程式)为_____。
(3)制取过程中先向饱和食盐水中通入较多的氨气,再通入足量的二氧化碳,其原因是:_____。
(4)但工业上不能用氨碱法制取碳酸钾,只是因为在溶液中_____。
A KHCO3溶解度较大
B KHCO3溶解度较小
C K2CO3溶解度较大
D K2CO3溶解度较小
【答案】(1)加热 (2)NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
(3)二氧化碳在食盐水中难溶 (4)A
【解析】
试题根据氨碱法制纯碱的实验原理进行分析,以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱。先使氨气通入饱和食盐水中而成氨盐水,再通入二氧化碳生成溶解度较小的碳酸氢钠沉淀和氯化铵溶液,即NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。将经过滤、洗涤得到的NaHCO3微小晶体,再加热煅烧制得纯碱产品。
所以,(1)上图中①是加热;(2)上述制取过程中的化学反应原理(用化学方程式)为NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl。
(3)由于二氧化碳微溶于水,若先通入二氧化碳,则溶液中会生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵;氨气在水中溶解度很大,先通入氨气,溶液中生成了较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵。
(4)用氨碱法制取碳酸钠主要是制取碳酸氢钠,由于碳酸氢钠的溶解度较小,在溶液中先析出,使得反应继续下去,从而制取较多的碳酸氢钠以用来制取碳酸钠。但是相同条件下,碳酸氢钾的溶解度较大,不会从溶液中析出,所以就得不到碳酸氢钾,也就不能用这种方法制取碳酸钾。故选A


科目:初中化学 来源: 题型:
【题目】(1)为了减少雾霾、大气中有害气体含量, 研究机动车尾气中 CO、 NOx及 CxHy)的排放意义重大。机动车尾气污染物的含量与“空/燃比” (空气与燃油气的体积比)的变化关系如图:

①利用氨气可将汽车尾气中的氮氧化物(NOx)在一定条件下转化为对空气无污染的物质。请将该反应的化学方程式补充完整:4xNH3+6NOx====(2x +3)N2+________。
②随“空/燃比”增大,CO和CxHy的 含量减少的原因是___________________________。
(2)有一固体物质可能含有碳酸钾、氧化铜、氯化钠、氯化铁中的一种或几种。现需要对此物质成分进行检测。甲同学向固体中加入足量的水,形成无色溶液A;取少量溶液A于试管中,加入几滴酚酞溶液,溶液变红色
①这一固体中可能有的物质是________________ (写化学式)。
②设计实验进一步确定混合物组成,取少量A溶液,依次用到的试剂是__________。(写化学式)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学小组利用如图所示装置(图中固定装置已略去)测定铜锌合金中锌的质量分数,探究过程如下:

①连接实验装置并检查装置气密性。
②向装置Ⅰ中的锥形瓶加入2.0g的铜锌合金样品粉末,由注射器缓缓注入稀硫酸,待到锥形瓶中不再产生气体时,准确读取注射器内读数,减少10.5mL稀硫酸,同时立即夹紧弹簧夹,移出装置Ⅲ中的导管,准确读取量筒内水的体积为214.0mL(注:样品中的杂质不参加反应
③装置Ⅰ中剩余固体物质经过适当处理后,准确称量其质量为1.4g
④该小组的三位同学利用实验过程测得不同数据,计算铜锌合金样品中锌的质量分数
甲同学利用装置Ⅰ中反应前后固体的质量进行计算;
乙同学利用装置Ⅰ中加入稀硫酸的量进行计算;
丙同学利用装置Ⅲ中量取水的体积进行计算,并查得:在标准状况下,氢气的密度为0.09gL-1。
回答下列问题:
(1)装置Ⅰ中反应的化学方程式为___,实验过程中须加入稀硫酸至不再产生气体,目的是___。
(2)步骤③中称量剩余固体之前的正确操作是_______、洗涤、干燥。
(3)根据实验测定的数据,上述三位同学中________(填“甲”、“乙”或“丙”)同学无法进行计算样品中锌的质量分数。
(4)化学小组同学发现:按照丙同学的方案进行计算,致使实验结果出现较大偏差。以下因素可能造成偏差的有________(填标号)。
A 移出装置Ⅲ时,导管内留存了一部分水
B 实验测量前,没有排除装置Ⅰ中的空气
C 数据处理时,未排除加入稀硫酸所占的体积
【答案】(1)![]() ;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
;使样品中的锌完全反应;(2)过滤;(3)乙;(4)AC;
【解析】
试题(1)由于铜排在了氢的后面,所以与酸不反应,反应物是锌和硫酸,生成物是硫酸锌和氢气,氢气后面标上上升符号;实验过程中须加入稀硫酸至不再产生气体,目的是使样品中的锌完全反应;(2)从铜和硫酸锌溶液的混合物中得到铜,先进行过滤,得到带有硫酸锌溶液的铜,再进行洗涤除去表面的硫酸锌,再进行干燥除去水即可;(3)根据加入稀硫酸的量进行计算需要知道稀硫酸的溶质质量分数,而题中没有告知;(4)由于锌与硫酸反应生成硫酸锌和氢气时,放出热量,如果没等冷却到室温,根据热涨冷缩的原理可知进入量筒中水偏多,所以误认为得到的氢气多,再就是数据处理时,未排除加入稀硫酸所占的体积,计算的结果就偏大;
考点:金属的化学性质;化学方程式;实验误差分析;
点评:熟记金属活动性顺序表,知道排在氢之前的金属和稀盐酸或者硫酸反应生成氢气,而排中氢之后的金属和稀盐酸或者稀硫酸不生成氢气;化学反应中物质的质量比都是纯净物之间的质量比,而溶液中溶质的质量=溶液质量×溶质质量分数;本题容易出错的地方是对实验结果的评价,要知道锌与硫酸反应放出热量,会造成相应的误差,必须冷却到室温才能进行观察和计算。
【题型】实验题
【结束】
30
【题目】用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和以水为溶剂制成的溶液与人们的生活有着密切的关系。
(1)市售的一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,饮料温度就会降低,这种固体物质可能是________(填字母)。
A 烧碱 B 食盐
C 硝酸铵 D 生石灰
(2)如图是常见固体物质的溶解度曲线,根据图示回答:

①对A物质来说,a点的意义是________________________________________________。
②将t1℃时,140gA的饱和溶液升温至t2℃,可用图上的________点表示。
③t2℃时A、B、C三种物质的饱和溶液的溶质质量分数由大到小的顺序是________。
④若将d点温度下A、B、C三种物质的饱和溶液降温至t1℃,没有晶体析出的是________物质。
(3)很多新型汽车使用铅酸蓄电池作为主要动力来源,避免了尾气的排放。某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,若用200g溶质质量分数为98%的浓硫酸配制该稀硫酸,需要蒸馏水的质量为________g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
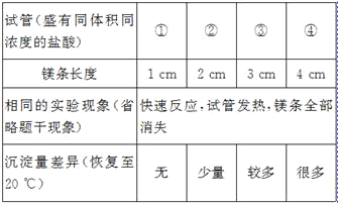
[得出结论]镁条与盐酸反应产生白色沉淀与_____有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | _____,白色沉淀_____ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀_____ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是:Mg2+、_____ |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】若6.5g锌与100g稀硫酸恰好完全反应。
(1)在100g稀硫酸中,溶质的化学式为______,其质量为___g,溶剂的化学式为____,其质量为_____g;
(2)完全反应后,所得溶液的质量为____g,其中溶质的化学式为______,其质量为____g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示,下列结论正确的是( )

A. 乙的溶解度小于甲的溶解度
B. 甲的溶解度受温度影响比乙大
C. t2℃时,100 g乙的饱和溶液中含乙50 g
D. 相同质量的甲、乙的饱和溶液由t2℃降至t1℃,析出晶体较多的是乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室现有高锰酸钾、稀盐酸、火柴、木块、棉花、药匙、镊子及以下仪器:

(1)若补充两种药品 和 (填名称),可制取并检验一种气体。
(2)若补充一种仪器 (填名称),还能制备并收集另一种气体,反应的化学方程式为 。
(3)如图所示:

①请连接A、B,使热水中的白磷燃烧,并将装置图补充完整。
②热水中的白磷能燃烧是因为试管内反应生成气体,管内气体增多,同时温度升高,压强 ,大于外界大气压,在 的作用下,气体逸出与白磷反应。
③停止加热时,先要 然后再 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛(Ti)抗腐蚀性能好,露置于空气中数年,仍光亮如初。以金红石(主要成分是 TiO2)为原料生产金属钛的步骤主要有:①在高温下,向金红石与焦炭的混合物中通入氯气(Cl2),得到TiCl4和一种可燃性气体;②在稀有气体环境和加热条件下,用Mg和TiCl4反应得到Ti和MgCl2。下列说法不正确的是( )
A. ①中的反应为TiO2+C+2Cl2![]() TiCl4+CO2
TiCl4+CO2
B. ②中的稀有气体的作用是隔绝空气
C. ②中发生的反应为置换反应
D. 金属钛在常温下不与O2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com