
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
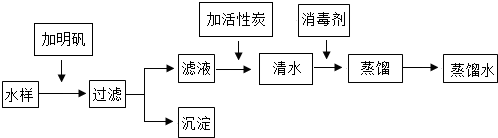
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 猜想 | 实验 | 预计现象 | 结论 |
| ① | 用磁铁吸引黑色粉末 | 若粉末全部被吸引 | 猜想①正确 |
| ② | 若全部没有被吸引 | 猜想②正确 | |
| ③ | 若全部被吸引 | 猜想③正确 |
查看答案和解析>>
科目: 来源: 题型:解答题
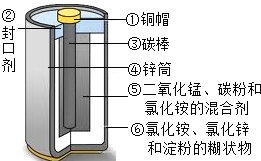
| 实 验 步 骤 | 实验现象 | 结论或解释 |
| (1)打开干电池,取出碳棒周围的黑色粉末. | / | / |
| (2)将粉末置于烧杯内,加入适量水溶解、过滤、洗涤、干燥 | 得到黑色粉末和无色澄清液体 | 黑色粉末的成份为二氧化锰和炭粉 |
| (3)对黑色粉末进行灼烧 | / | 得到纯净的MnO2固体 |
| (4)取少量第(2)步中得到的无色澄清液体于试管,检验第②步中得到的无色澄清液体中是否含铵根离子的方法是:取样于试管中,加入氢氧化钠溶液并加热(把湿润的红色石蕊试纸放在试管口) | 强烈刺激性气味(或湿润的红色石蕊试纸变蓝色) | 结论:无色溶液中含铵根离子.化学方程式为: NH4Cl+NaOH═NaCl+H2O+NH3↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 反应前质量(g) | 8 | 10 | 1 | 25 |
| 反应后质量(g) | 未测 | 24 | 2 | 16 |
| A. | A和D的计量系数之比为2:3 | |
| B. | 反应后A的质量为6g | |
| C. | 若该反应继续进行,充分反应后剩余D的质量为13g | |
| D. | 该反应的类型为分解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液的均一性可以指同一溶液的物理性质完全一样 | |
| B. | 溶液的均一性可以指同一溶液的化学性质完全一样 | |
| C. | 溶液的稳定性是指溶液的化学性质稳定 | |
| D. | 溶液的稳定性是指溶液静置后不会分层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com