
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
 某同学用如图所示装置进行实验(图中铁架台等仪器均已略去).在甲试管中加入试剂后,塞紧橡皮塞,立即打开止水夹,乙试管中有气泡冒出;一段时间后关闭止水夹,乙试管中液面上升,溶液由澄清变浑浊.符合上述实验现象的甲、乙试管中应加入的试剂是( )
某同学用如图所示装置进行实验(图中铁架台等仪器均已略去).在甲试管中加入试剂后,塞紧橡皮塞,立即打开止水夹,乙试管中有气泡冒出;一段时间后关闭止水夹,乙试管中液面上升,溶液由澄清变浑浊.符合上述实验现象的甲、乙试管中应加入的试剂是( )| A | B | C | D | |
| 甲 | Zn、稀H2SO4 | Cu、稀H2SO4 | CaCO3、稀HCl | Na2CO3、稀H2SO4 |
| 乙 | BaCl2 | Ba(OH)2 | KNO3 | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
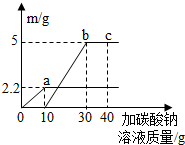 某实验小组的同学取大理石和稀盐酸反应后的废液50g,逐滴加入质量分数为26.5%的碳酸钠溶液.他们根据实验测得的数据绘出如图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量.下列说法正确的是( )
某实验小组的同学取大理石和稀盐酸反应后的废液50g,逐滴加入质量分数为26.5%的碳酸钠溶液.他们根据实验测得的数据绘出如图,其中纵坐标m是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量.下列说法正确的是( )| A. | 图中oa段表示生成的沉淀量 | |
| B. | c点表示碳酸钠恰好完全反应 | |
| C. | 与50g废液恰好完全反应时消耗碳酸钠的质量为30g | |
| D. | 最终产生气体的质量为2.2g |
查看答案和解析>>
科目: 来源: 题型:填空题
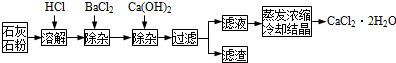
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
| 选项 | 实验目的 | 实验设计 |
| A | 从空气中获取纯净的氮气 | 用硫燃烧除去空气中的氧气 |
| B | 鉴别硬水和软水 | 观察颜色或闻气味 |
| C | 除去混在二氧化碳中的氯化氢气体 | 把混合气体通过足量的氢氧化钠溶液 |
| D | 鉴别硝酸铵和氯化钠固体 | 加适量的水溶解,测量前后温度变化 |
查看答案和解析>>
科目: 来源: 题型:解答题
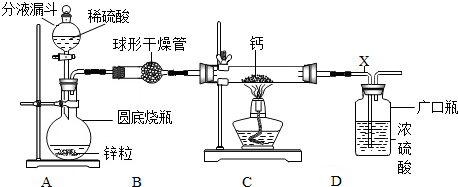
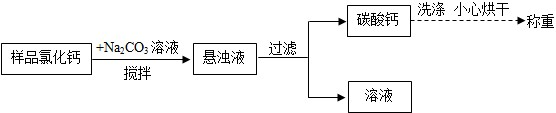
查看答案和解析>>
科目: 来源: 题型:填空题
| 选项 | A | B | C | D |
| 实验目的 | 除去氢氧化钠中 少量的碳酸钠 | 清洗铁制品 表面的铁锈 | 鉴别氯化钠 溶液和稀盐酸 | 检验一氧化碳中是否混有少量二氧化碳 |
| 方案1 | 加水溶解 | 加适量稀盐酸 | 加锌粒 | 点燃 |
| 方案2 | 加稀硫酸 | 用水洗涤 | 加石蕊溶液 | 通入澄清石灰水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①为置换反应 | |
| B. | 氢氧化钴可以干燥氯化氢气体 | |
| C. | 酚酞指试剂中加入氢氧化钴,试剂不会变红色 | |
| D. | 钴的金属活动性比铜的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com