
���ۡ�8.12����ը�¹��У���ը��������軯��й©������ͨ������˫��ˮ�������������Һ���������Լ��ỷ����Ⱦ��
���ϣ��軯�ƻ�ѧʽNaCN��CԪ��+2�ۣ�NԪ�ة�3�ۣ�����ɫ�ᾧ�������綾��������ˮ��ˮ��Һ�ʼ��ԣ���ˮ�������軯�⣮
I����1��NaCNˮ��Һ�ʼ��ԣ���ԭ����____________�������ӷ���ʽ���ͣ���
��2��˫��ˮ��������NaCN�����������¼���H2O2���ɵõ������һ����ɫ��ζ�������壬�÷�Ӧ�����ӷ���ʽΪ____________________��
��3���ǽ�����N______C����������������������������ʵ��֤����_____________��
II��ij��ѧ��ȤС��ʵ�����Ʊ���������ƣ�Na2S2O3����������������������Һ��������軯�Ʒ�ˮ�ܷ����ŷţ�
[ʵ��һ]ʵ����ͨ����ͼװ���Ʊ�Na2S2O3��
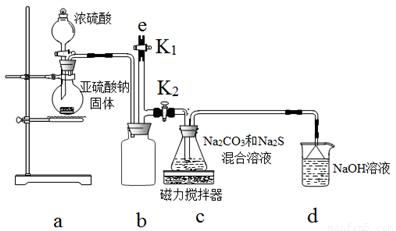
��3��bװ�õ�������_______________��
��4��cװ���еIJ�����Na2S2O3��CO2�ȣ�dװ���е�������NaOH��Na2CO3����������__��
��5��ʵ���������e���������ʢ__��ѡ�NaOH��Һ������ˮ������CCl4������һ�֣���ע�������ٹر�K2��K1��ֹ���װ��ʱ��Ⱦ������
[ʵ���]�ⶨ�������������Һ������ķ�ˮ���軯�Ƶĺ�����
��֪���ٷ�ˮ���軯�Ƶ�����ŷű�Ϊ0.50mg/L��
��Ag++2CN��=[Ag(CN)2] ����Ag++I��=AgI����AgI�ʻ�ɫ����CN ��������Ag+��Ӧ��
ʵ�����£�ȡ25.00mL��������軯�Ʒ�ˮ����ƿ�У����μӼ���KI��Һ��ָʾ������1.000��10��4mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ2.50mL��
��6���ζ��յ���жϷ�����_______________��
��7��������ķ�ˮ���軯�Ƶĺ���Ϊ_______________mg/L��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�긣��ʡ��һ��ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
����������Ũ�����ܽ�ľ̿��������CO2����������ԭ��SO2��������ͼ���и�װ�����һ��ʵ�飬����֤������Ӧ�������ĸ��ֲ��

��1����Щװ�õ�����˳���ǣ������������������ҵķ�����дװ�õı�ţ���______��____��____��____��
��2��ʵ��ʱ�ɹ۲쵽װ�â���Aƿ����Һ��ɫ��Aƿ��Һ��������_________��Bƿ��Һ��������_______�� Cƿ��Һ��������________________��д��B�з��������ӷ���ʽ__________��
��3��װ�â������ӵĹ���ҩƷ��____________������֤�IJ�����____________��
��4��װ�â�����ʢ��Һ��_____________������֤�IJ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ�����и�һ��ѧ������ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ӡˢ��·ʱ�����Ȼ�����Һ��Ϊ����ʴҺ��,�����ķ�ӦΪ2FeCl3��Cu��2FeCl2��CuCl2����ʢ���Ȼ�����Һ���ձ���ͬʱ�������ۺ�ͭ��,��Ӧ������,���н�������ܳ��ֵ����ձ��У� ��
A. ��ͭ���� B. ������ͭ C. ����ͭ���� D. ����ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����2���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��֪��CH3Cl������Ϊ��̬��������ˮ���������Ҵ����л��ܼ���ʵ�����Ʊ�CH3Clԭ��Ϊ��CH3OH+HCl(Ũ) 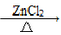 CH3Cl(g)+H2O
CH3Cl(g)+H2O
��1��ʵ�鲽�����£�
�ٸ���ZnCl2���塣ʵ���Ҹ���ZnCl2�����Ƶ���ˮZnCl2�ķ�����____��
�ڳ�ȡ13.6g��ϸ����ˮZnCl2����ȡ20mLŨ���ᡢһ������CH3OH���ֱ����װ��______����װ�ñ�ţ��Ķ�Ӧ�����У�

�۲�����CH3Cl���壬���ѡ����ˮ���ռ���ԭ����___________��
��2��Ϊ̽��CH3Cl��CH4�����ȶ��ԵIJ��ij��ѧ��ȤС�����ʵ����֤CH3Cl�ܱ�ǿ���������Ը��������Һ������
�ٽ�CH3Cl�Ʊ�װ���в�������������ͨ����������ϴ��ƿ______����˳����ϴ��ƿ��ţ�������۲쵽A����ɫ��ȥ��ʵ��������֤��CH3Cl�ȶ�������CH4��
��ʵ������з��֣�ϴ��ƿA����ɫ��ȥ�ˣ�������һ�ֻ���ɫ�����һ����ɫ���壬���䷢����Ӧ�����ӷ���ʽ��_________�� ϴ��ƿC�з�����Ӧ�����ӷ���ʽ��____________��
��Ϊ����δ��Ӧ���CH3Cl����Ӧ������ϴ��ƿ���һֻʢ_________�����Լ����ƣ���ϴ��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ����2���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A. ��ˮ�����ķ�����Ҫ�е����������������ӽ�������
B. ����ֲ����и��������������˴Ӻ���Ʒ����ȡ���ǻ�ȡ�����Ҫ;������ҵ�Ӻ�������ȡ�⾭���IJ����У����ݡ����ˡ���������ȡ���ֵ��ᴿ
C. �ִ��Ƽ��Ѿ��ܹ��ĵ�����ġ���Ƭ����ֱ�۵�֤ʵ��ˮ���Ӽ�������һ��ˮ�����е���ԭ������һ��ˮ�����е���ԭ�Ӽ��γɵĻ�ѧ��
D. ĥ�����Ĵ��������ʣ�������к��ʱ���˰�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017���Ĵ�ʡ����2���¿������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ���ǣ�������
A. ������ �ķ���ʽΪC13H9O4N2
�ķ���ʽΪC13H9O4N2
B. �ڼ��������£�CH3CO18OC2H5��ˮ�������CH3COOH��C2H518OH
C. ��һ�������£����ᡢ�������ᡢ�����ʾ�����NaOH������Ӧ
D. 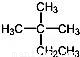 ��ϵͳ����Ϊ2������2���һ�����
��ϵͳ����Ϊ2������2���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ���ڳ����Ի�ѧ�Ծ��������棩 ���ͣ��ƶ���
������F�Ǻϳɿ�����ҩ��³˹���Ƶ���Ҫ�м��壬��ϳɹ������£�
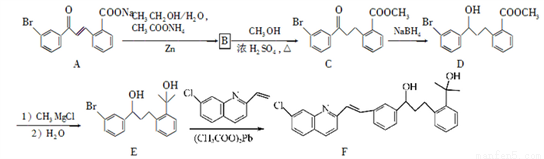
��ش��������⣺
��1��������C�к�����������Ϊ________��________�������ƣ���
��2��������B�ķ���ʽΪC16H13O3Br��B�Ľṹ��ʽΪ________��
��3����C��D��E��F�ķ�Ӧ��������Ϊ________��________��
��4��д��������������C��һ��ͬ���칹��Ľṹ��ʽ________��
�����ڷ����廯����ҷ����к���2������
���ܹ�����������Ӧ
��������5�ֲ�ͬ��������ԭ�ӣ�
��5����֪��RCl RMgCl��д��CH3CH2OH��
RMgCl��д��CH3CH2OH�� Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ�������ܼ������Լ����ã���________
�ĺϳ�·������ͼ�������ܼ������Լ����ã���________
�ϳ�·������ͼʾ�����£�H2C=CH2 CH3CH2Br
CH3CH2Br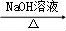 CH3CH2OH��
CH3CH2OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��ɳ�и߶���ѧ�ڵ�һ��ģ���⻯ѧ�Ծ��������棩 ���ͣ������
��.��ҵ�ϳɰ����Ʊ�����һ��������������ش��������⣺
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO+H2O(g) CO2+H2��T��ʱ����1L�ܱ������г���0.2mol CO��0.3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L��1�����¶��´˷�Ӧ��ƽ�ⳣ��K=_______�������������
CO2+H2��T��ʱ����1L�ܱ������г���0.2mol CO��0.3molˮ��������Ӧ����ƽ�����ϵ��c(H2)=0.12mol��L��1�����¶��´˷�Ӧ��ƽ�ⳣ��K=_______�������������
��2�����᳧��β��ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ��������ﻹԭΪ������ˮ���䷴Ӧ����Ϊ��
CH4(g)+4NO2(g)��4NO(g)+CO2(g)+2H2O(g) ��H=��574kJ��mol��1
CH4(g)+4NO(g)��2N2(g)+CO2(g)+2H2O(g) ��H=��1160kJ��mol��1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��________________________________ ��
��3�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����ѧ�����ô�ԭ������Ƴɰ���-����ȼ�ϵ�أ���ͨ�백���ĵ缫�ڼ��������·�����Ӧ�ĵ缫��ӦʽΪ____________________��
��.�״���һ����Ҫ���л�����ԭ�ϣ���������ȡ���ѡ�һ���¶��£����������Ϊ1.0L�ĺ����ܱ������з�����Ӧ��2CH3OH��g�� CH3OCH3��g��+ H2O��g����
CH3OCH3��g��+ H2O��g����
���� ��� | �¶�(��) | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
CH3OH��g�� | CH3OCH3��g�� | H2O��g�� | ||
I | 387 | 0.20 | 0.080 | 0.080 |
II | 387 | 0.40 | a | b |
III | 207 | 0.20 | 0.090 | 0.090 |
(4) ����I�еķ�Ӧ�ﵽƽ��ʱ�����ʱ��_______(����ڡ���С�ڡ������)����II�еġ�
(5) a=_____
(6) ����˵������˵���÷�Ӧ�ﵽƽ��״̬����__________��������ĸ)
A. ������ѹǿ���� B. ���������c(CH3OCH3) ����
C. ���������ܶȲ��� D. ��λʱ��������1 mol CH3OCH3 ͬʱ����2molCH3OH
(7)��֪����������Ӧ(m��n������0)��
��Ӧ�٣�CO(g)+2H2(g)  CH3OH(g)���� ��H=��m kJ��mol-1
CH3OH(g)���� ��H=��m kJ��mol-1
��Ӧ�ڣ�2CO(g)+4H2(g)  CH3OCH3(g)+H2O(g)�� ��H= ��n kJ��mol-1����
CH3OCH3(g)+H2O(g)�� ��H= ��n kJ��mol-1����
������m��n�Ĺ�ϵ�У���ȷ����__________������ĸ)��
A. n��2m������ B. m��2 n���� C. 2m��n ���� D. m��3n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡЭ���������ѧ�ڵ�һ���������ۻ�ѧ�Ծ��������棩 ���ͣ������
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȡ� | |
500 | 800 | ||
��2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
��3H2(g)+CO2(g) | K3 | ||
��1����Ӧ����________________������ȡ����ȡ�����Ӧ��
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ��������ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A)_____________K(B)������������������������ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=_______����K1��K2��ʾ����
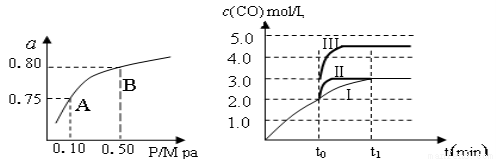
��3����3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c(CO)�뷴Ӧʱ��t�仯���ߢ�������ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ�
�����ߢ��Ϊ���ߢ�ʱ���ı��������_____________________��
�����ߢ��Ϊ���ߢ�ʱ���ı��������_____________________��
��4��һ�ּ״�ȼ�ϵ�أ�ʹ�õĵ������Һ��2mol��L��1��KOH��Һ��

��д������(ͨ��)b����һ���ĵ缫��Ӧʽ_________________��
ÿ����6.4g�״�ת�Ƶĵ�����Ϊ_______________��
��5��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����b mol/LBa(OH)2��Һ�������Ϻ���Һ�У�2c(Ba2��)= c(CH3COO-)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��KaΪ________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com