
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
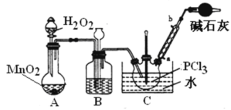
资料:① Ag+ + SCN- =AgSCN↓,Ksp(AgCl) >Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)PCl3分子中各原子均满足8电子稳定结构,则PCl3的电子式为____。
(2)B中所盛的试剂是____,干燥管的作用是________。
(3)POCl3遇水反应的化学方程式为_____________。
(4)反应温度要控制在60~65℃,原因是:__________。
II.工业上可用氯化水解法生产三氯氧磷,工艺流程如下:
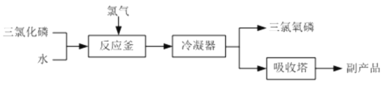
(5)氯化水解法生产三氯氧磷的化学方程式为____。
(6)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
a、准确称取30.7 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
b、取10. 00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol·L-1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以X为指示剂,用0.2 mol·L-1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤c中加入硝基苯的作用是____。
②步骤d中X为______。
A FeCl2 B NH4Fe(SO4)2 C 淀粉 D 甲基橙
③三氯氧磷产品中Cl元素的质量百分含量为____。
【答案】![]() 浓硫酸 防止空气中的水蒸气进入三颈烧瓶 POCl3+3H2O=H3PO4+3HCl 温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低 PCl3 +Cl2 + H2O= POCl3+2HCl 防止在滴加NH4SCN溶液时,将AgCl沉淀转化为AgSCN沉淀 B 34.7%
浓硫酸 防止空气中的水蒸气进入三颈烧瓶 POCl3+3H2O=H3PO4+3HCl 温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低 PCl3 +Cl2 + H2O= POCl3+2HCl 防止在滴加NH4SCN溶液时,将AgCl沉淀转化为AgSCN沉淀 B 34.7%
【解析】
实验室采用氧气氧化液态PCl3法制取POCl3,参与反应的氧气必须是干燥的,且要防止空气中的水蒸气进入三颈烧瓶使PCl3水解;工业上用氯化水解法生产三氯氧磷,实验原理是:PCl3+Cl2 + H2O= POCl3+2HCl;由于n(Cl)=n(Ag+),故测定三氯氧磷产品中Cl元素的质量百分含量即可通过银离子的消耗量来测定:用NH4SCN溶液滴定溶液中过量的Ag+,而Fe(SCN)3溶液是血红色溶液,所以可用含有Fe3+的NH4Fe(SO4)2溶液作指示剂,当溶液中Ag+反应完全后,再滴加的NH4SCN溶液就会与溶液中的Fe3+作用,使溶液变为血红色。
(1)PCl3分子中各原子均满足8电子稳定结构,则磷原子与氯原子形成三个共用电子对,其电子式为:![]() ;
;
(2)参与反应的氧气必须是干燥的,因此B中所盛的试剂是浓硫酸,用来干燥氧气;干燥管中碱石灰的作用防止空气中的水蒸气进入三颈烧瓶而使PCl3水解;
故答案为:浓硫酸;防止空气中的水蒸气进入三颈烧瓶;
(3)POCl3遇水会发生反应,根据原子守恒可知反应的方程式为POCl3+3H2O=H3PO4+3HCl;
(4)由于温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低,所以反应温度要控制在6065℃;
故答案为:温度过低,反应速度太慢,且温度过高,PCl3易挥发,利用率低;
(5)氯化水解法是用三氯化磷、氯气与水反应生成三氯氧磷和盐酸,其化学方程式为:PCl3+Cl2 + H2O= POCl3+2HCl;
(6)①已知AgSCN沉淀的溶解度比AgCl小,可加入硝基苯用力摇动,使AgCl沉淀表面被有机物覆盖,防止在滴加NH4SCN溶液时,将AgCl沉淀转化为AgSCN沉淀;
②由于是用NH4SCN溶液滴定溶液中过量的Ag+,而Fe(SCN)3溶液是血红色溶液,所以可用含有Fe3+的NH4Fe(SO4)2溶液作指示剂,当溶液中Ag+反应完全后,再滴加的NH4SCN溶液就会与溶液中的Fe3+作用,使溶液变为血红色,即滴定终点的现象为溶液由无色变为血红色,且30s不褪色,故答案为:B;
③关系式可知:n(Cl)=n(Ag+),![]() ,所以三氯氧磷产品中Cl元素的百分含量为
,所以三氯氧磷产品中Cl元素的百分含量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+ Cl-(aq)
Ag+(aq)+ Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl 转化为AgI
D.实验可以证明AgI比AgCI更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3+2H2O,部分夹持仪器已略去)
CaCl2+2NH3+2H2O,部分夹持仪器已略去)
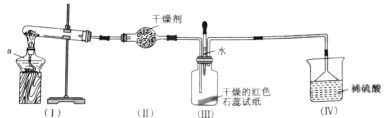
(实验探究)(1)装置(I)中仪器a的名称是_____。
(2)装置(Ⅱ)中可用_________(填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___(填“白色”或“蓝色”)原因是氨水呈____(填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______(填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________。
(5)装置(IV)中稀硫酸的作用是___________。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____mol。
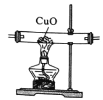
(实验拓展)(7)已知:2NH3+3CuO![]() 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____(填“白色”或“红色”),在这过程中NH3表现出__(填“还原性”或“氧化性”)。
(知识应用)(8)氨气是一种重要的化工原料。写出它的一种用途:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题。
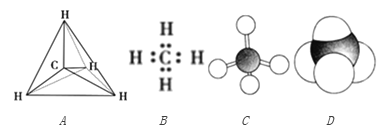
(1)甲烷的比例模型是________,甲烷的电子式是__________ (填序号)。
(2)写出甲烷与氯气发生反应的化学方程式_____________(只写第一步),该反应的反应类型是________________。
(3)相对分子质量为100的烷烃的分子式是_______________。
(4)甲烷与丙烷互为________。
A. 同位素 B. 同素异形体 C. 同系物 D. 同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0 L w mol·L-1 CH3COOH 溶液与0.1 mol NaOH固体混合,充分反应。向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH随加入CH3COOH或CH3COONa固体的物质的量的变化关系如图所示。下列叙述正确的是
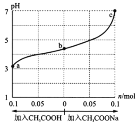
A.b点混合液中c(H+)≥ c(OH-) + c(CH3COO-)
B.加入CH3COOH过程中,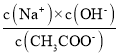 增大
增大
C.25℃时,CH3COOH的电离平衡常数 Ka= ![]() mol·L-1
mol·L-1
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢是危害性极强的毒性气体,也是恶臭气体的主要成分之一。![]() 菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法正确的是( )
菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法正确的是( )
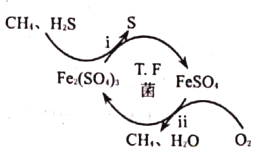
A.![]() 在脱硫过程中被还原
在脱硫过程中被还原
B.温度越高,越有利于天然气的催化脱硫
C.该脱硫过程需要不断添加![]() 溶液
溶液
D.理论上,需要氧气的体积是相同状态下![]() 体积的一半
体积的一半
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
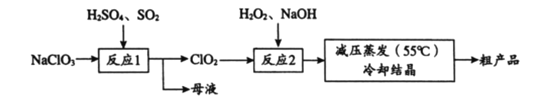
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是我国自主研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
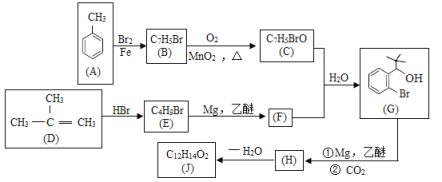
已知:
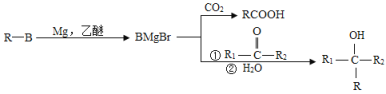
回答下列问题:
(1)B的结构简式是______;C中的官能团名称是____。
(2)D生成E的化学方程式为________。
(3)H→J的反应类型是_________。
H在一定条件下自身缩聚生成高分子化合物的结构简式是_______。
(4)根据![]() ,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为_____。X有多种同分异构体,其中满足下列条件的同分异构体共有______ 种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无-O-O-键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯为原料,合成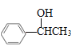 路线流程图(其它试剂自选):_______。
路线流程图(其它试剂自选):_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com