
A是一种重要的化工原料,C、F的分子式都为C2H4O,F是没有不饱和键的环状有机物,G的分子式为C2H6O2,G中含有两个相同的官能团,转化关系如下图:

己知:同一碳原子上连接2个或2个以上—OH是不稳定结构
请回答:
(1)有机物C中含有的官能团名称是_________________。
(2)有机物E的结构简式______________。
(3)F→G的化学方程式是_______________。
(4)下列说法正确的是____________。
A.有机物D能使石蕊溶液变红
B.用新制碱性氢氧化铜悬浊液无法区分有机物B、C、D的水溶液
C.等物质的量的A和B分别完全燃烧消耗氧气的量相等
D.可用饱和碳酸钠溶液除去有机物E中混有的少量B、D
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
关于合金性质的说法中,错误的是( )
A. 合金的硬度一般比其各成分金属的硬度高
B. 合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的的物理性质不同
D. 合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:简答题
硒(Se),是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se原子的核外电子排布式为____________。
(2) 比较As的第一电离能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的键角比SeO3的键角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒单质是红色或灰色粉末,带灰色金属光泽的准金属,灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
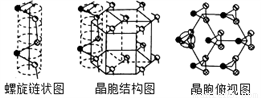
螺旋链中Se原子的杂化方式为__________。己知正六棱柱的边长为acm,高为b cm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的Se原子个数为_________,该晶体的密度为___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
以下有机物同分异构体数目判断中不正确的是
A. 立方烷( )的六氨基(-NH2)取代物有3种。
)的六氨基(-NH2)取代物有3种。
B. C3H7ClO(有羟基)的同分异构体数目有5种
C. 甲苯与氢气充分加成后的—溴代物有4种。
D. 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:简答题
Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如下:
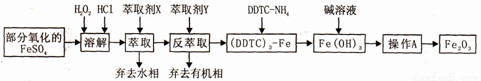
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离。
② 3DDTC-NH4+Fe3+= (DDTC) 3-Fe↓+3NH4+
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是____________。
A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图用力振摇

D.振摇几次后需打开分液漏斗上口的玻璃塞放气
E.经几次振摇并放气后,手持分液漏斗静置待液体分层
F.分液时,将分液漏斗上的玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,打开旋塞,待下层液体完全流尽时,关闭旋塞后再从上口倒出上层液体
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是_______________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为_________________。

(4)操作A为______________________。
(5)现准确称取4.000g , 样品,经酸溶、还原为Fe2+,在容量瓶中配成100mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.l000mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80mL。
① 用移液管从容量瓶中吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为_____。
② 产品中铁的含量为_______(假设杂质不与K2Cr2O7反应)。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
己知反应:2Al(l)  B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是

A. a代表20℃下A的Y-t曲线
B. 反应到66min时,0℃和20℃下反应放出的热量相等
C. 0℃和20℃下达到平衡时,反应都放出QkJ热量
D. 反应都达到平衡后,正反应速率a > b
查看答案和解析>>
科目:高中化学 来源:2017届浙江省宁波市高三新高考选考适应性考试化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
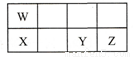
A. 原子半径大小:X > Y > Z
B. W、Y两种元素都能与氧元素形成化合物WO2、YO2
C. 最高价氧化物对应水化物的酸性:W > Y > Z
D. W元素的单质能从X的氧化物中置换出X单质
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:实验题
1.
硫代硫酸钠是一种重要的化工产品,某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,受热、遇酸均反应,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
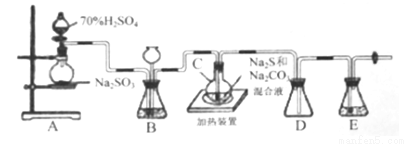
烧瓶C中发生反应如下:
Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)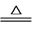 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
(1)检查装置气密性。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若__________,则整个装置气密性良好:装置E的作用是__________。
(2)按图示加入试剂。向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再加热C,A中反应的化学方程式是______;为提高产品纯度,应使C中Na2CO3和Na2S恰好完全反应,则C烧瓶中Na2CO3和Na2S物质的量之比为_______ 。
(3)装置B的另一作用是观察SO2的生成速率,其中的液体最好选择_____。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中要控制SO2生成速率,使SO2缓慢进入C中可采取的措施有_______;为了保证硫代硫酸钾的产量,该实验一般控制在碱性环境下进行。否则产品发黄,原因是______。
(4)等Na2S和Na2CO3完全消耗后,结束反应。趁热过滤C中混合物,将滤液水浴加热浓缩、_____,经过滤、洗涤、干燥,得到产品。
Ⅲ.[探究与反思]
为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择),若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省四地六校高一下学期第一次联考(3月)化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 浓硝酸必须保存在棕色瓶中 B. 铵盐应密封保存于阴凉处
C. pH=6的降雨是酸雨 D. SO2、NO2、可吸入颗粒物等过量排放导致雾霾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com