

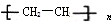 ,B发生催化氧化生成C,被酸性高锰酸钾溶液生成D,则B为醇,C为醛,D为羧酸,故CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生催化氧化生成C为CH3CHO,B氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOCH2CH3,据此解答.
,B发生催化氧化生成C,被酸性高锰酸钾溶液生成D,则B为醇,C为醛,D为羧酸,故CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生催化氧化生成C为CH3CHO,B氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOCH2CH3,据此解答.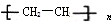 ,B发生催化氧化生成C,被酸性高锰酸钾溶液生成D,则B为醇,C为醛,D为羧酸,故CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生催化氧化生成C为CH3CHO,B氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOCH2CH3,
,B发生催化氧化生成C,被酸性高锰酸钾溶液生成D,则B为醇,C为醛,D为羧酸,故CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH发生催化氧化生成C为CH3CHO,B氧化生成D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOCH2CH3, ,故答案为:
,故答案为: ;
;| 浓硫酸 |
| △ |
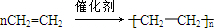 ,
,| 浓硫酸 |
| △ |
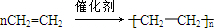 ,加聚反应.
,加聚反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢的摩尔质量为l g/mol |
| B、1个氮分子的摩尔质量为28 g |
| C、水的摩尔质量为18 g |
| D、NO3-的摩尔质量为62 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、学生甲认为苯酚不慎沾在皮肤上时,根据苯酚能够与65℃以上的水任意比混溶,所以最好马上用65℃以上的水进行洗涤 |
| B、学生乙在做酸碱中和滴定实验时,将标准液盐酸溶液通过移液管移入锥形瓶,并滴加1-2滴酚酞作为指示剂,而待测液氢氧化钠溶液装入碱式滴定管进行滴定 |
| C、学生丙在称量某固体样品的质量时,托盘一端放入5克砝码,并将游码用镊子沿着刻度尺向盛样品的一端移动后,停在1.2克和1.3克偏右的某一处时,天平平衡,该生马上得到该样品的质量为6.3克 |
| D、学生丁在做中和热测定时,认为应用稀的含等物质的量的H+和OH-的溶液反应来进行测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
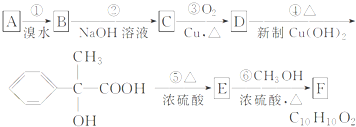
 ,满足上述条件的除A外还有
,满足上述条件的除A外还有查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

 耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.
耗NaOH溶液的体积,分别计算乙酰水杨酸的质量分数.在上述测定过程中,为防止乙酰水杨酸在滴定过程中水解,应如何正确操作?并说明理由.
查看答案和解析>>
科目:高中化学 来源: 题型:
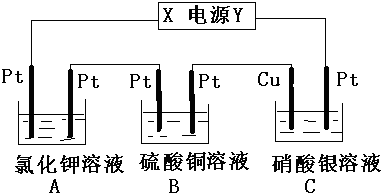
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com