
(10分)根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+H2(g) 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol
② I2(s)+H2(g) 2HI(g)△H=+26.48 kJ/mol
2HI(g)△H=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式: 。
(2)若反应②吸收52.96kJ热量时,转移电子的物质的量是 mol。
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是 。
A. 容器中气体压强不变
B. 容器中气体密度不变
C. 容器中气体颜色的深浅不变
D. 有n个H—H键断裂的同时有2n个H—I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是 。
(5)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液的蓝色消失时,立即关闭活塞A。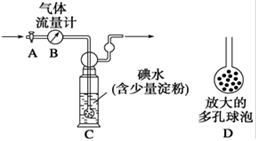
①用碘水测定SO2的含量的化学方程式是 。
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是 。
③洗气瓶C中溶液的蓝色消失后,没有及时关闭活塞A,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol I2(s)中通入2gH2(g),反应吸热26.48 kJ | B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ | C、反应(ii)的反应物总能量比反应(i)的反应物总能量低 | D、反应(i)放出的热量多,所以产物的能量低,比反应(ii)的产物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应(ii)的产物比反应(i)的产物稳定 | B、1molI2(s)比1molI2总能量低35.96kJ | C、254gI2中通入2gH2(g)充分反应放热9.48 kJ | D、反应(ii)反应物的总能量比反应(i)反应物的总能量高l7 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com