
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
【答案】B
【解析】A、2.1g丙烯的物质的量为![]() =0.05mol,0.05mol丙烯中含有0.15mol碳碳共用电子对、0.3mol碳氢共用电子对,总共含有0.45mol共用电子对,所含的共用电子对总数为0.45NA,故A错误;B、4.6gNO2和N2O4的混合气体含有最简式NO2的物质的量为0.1mol,含有1mol氮原子,含有的氮原子数为0.1NA,故B正确;C、标况下2.24L氧气的物质的量为
=0.05mol,0.05mol丙烯中含有0.15mol碳碳共用电子对、0.3mol碳氢共用电子对,总共含有0.45mol共用电子对,所含的共用电子对总数为0.45NA,故A错误;B、4.6gNO2和N2O4的混合气体含有最简式NO2的物质的量为0.1mol,含有1mol氮原子,含有的氮原子数为0.1NA,故B正确;C、标况下2.24L氧气的物质的量为![]() =0.1mol,生成0.1mol氧气转移了0.2mol电子,转移电子数目为0.2NA,故C错误;D、56g氮气的物质的量为2mol,12g氢气的物质的量为6mol,由于合成氨的反应为可逆反应,所以充分反应后生成氨气的物质的量小于4mol,生成NH3的分子数小于4NA,故D错误;故选B。
=0.1mol,生成0.1mol氧气转移了0.2mol电子,转移电子数目为0.2NA,故C错误;D、56g氮气的物质的量为2mol,12g氢气的物质的量为6mol,由于合成氨的反应为可逆反应,所以充分反应后生成氨气的物质的量小于4mol,生成NH3的分子数小于4NA,故D错误;故选B。


科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO
②单位时间内生成n molO2的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:其中A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
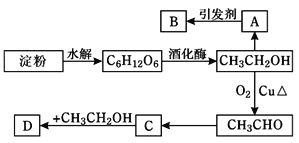
(1)“C6H12O6”的名称是________,工业上由石蜡制取A的方法称作____。C中含有官能团名称是____________;
(2)A→B反应类型为_________________;C→D反应类型为_________________;
(3)写出下列转化的化学方程式
①A→B:__________________;
②C→D:___________________________;
③CH3CH2OH→CH3CHO:_________________________。
(4)已知A能使酸性高锰酸钾褪色,还原产物为Mn2+,写出该氧化还原反应的离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时H2C2O4的pKa1=1.22,pK a2=4.19,CH3COOH的pK a=4.76(电离常数K的负对数-1gK=pK)。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 0.1 mol·L-1KHC2 O 4溶液滴加氨水至中性:(NH4+)<c(C2O42-)
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:C(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 0.1 mol·L-1CH3COONa溶液中滴加KHC2O4溶液至PH=4.76;c(K+)>c(Na+)>c(HC2O4-)>c(C2O42-)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰铵晶体可用作织物和木材加工的防火剂等。由二氧化锰等作原料制取硫酸锰铵晶体步骤如下:

(1)实验前,需称量MnO2的质量,这是因为____________________________。
(2) “制取MnSO4”时,可用C6H12O6(葡萄糖)、H2C2O4(草酸)等物质作还原剂。
①用C6H12O6作还原剂(被氧化为CO2)时,发生反应的n(MnO2)/n(C6H12O6)=________。
②用H2C2O4作还原剂,发生反应的化学方程式为____________________________。
(3)一种测定硫酸锰铵晶体[设为: (NH4)xMny(SO4)z·wH2O]组成的方法如下:
①称取一定量的硫酸锰铵晶体配成250 mL溶液A。
②取25.00 mL溶液A加入足量的BaCl2溶液得BaSO4 0.512 6 g。
③另取25.00 mL溶液A加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min[4NH![]() +6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
+6HCHO===3H++6H2O+(CH2)6N4H+,滴定时,1 mol(CH2)6N4H+与1 mol H+相当],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH标准溶液滴定至终点(在该过程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
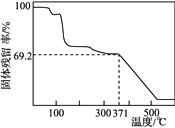
④取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在371 ℃时已完全失去结晶水)。根据以上实验数据计算确定硫酸锰铵晶体的化学式(写出计算过程)。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为 _____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b= ____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质分类全部正确的是
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氨 ⑥KClO3
A. 碱①④B. 纯净物③④⑤C. 盐①⑥D. 混合物②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com