
【题目】环戊二烯可用于制备二茂铁[Fe(C5H5)2];二茂铁分子是一种金属有机配合物,结构如图所示,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。下列说法正确的是( )
A.1mol环戊二烯(![]() )中含有5NA σ键
)中含有5NA σ键
B.二茂铁分子中存在配位键
C.环戊二烯分子中所有原子共平面
D.Fe2+的价电子排布式为3d44s2
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2A在溶液中存在如下电离:H2A=H++HAˉ,HAˉ![]() H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
H++A2ˉ,K=1.2×10-2。设NA为阿伏加德罗常数值。关于常温下0.01mol·L-1的H2A溶液,下列说法正确的是
A.![]()
B.pH<2
C.c(H+)=2c(H2A)+c(HAˉ)+c(OHˉ)
D.1L溶液中的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,随着聚酯工业的快速发展,将氯化氢转化为氯气的技术成为科学研究的热点。传统的Deacon直接氧化法,按下列催化过程进行:4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
(1)写出上述反应的平衡常数表达式K=___。
(2)生产过程中可使用CuCl2作催化剂,反应原理如下:
CuCl2(s)+![]() O2(g)=CuO(s)+Cl2(g) △H1=+63kJmol-1
O2(g)=CuO(s)+Cl2(g) △H1=+63kJmol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) △H2=-121kJmol-1
则4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的△H=___kJmol-1。
(3)生产中反应温度通常控制在420℃左右,原因是___。在一定温度下,进一步提高HCl平衡转化率的方法是___(写出2种)。
(4)420℃时,将一定量的O2和HCl通入4L的恒容密闭容器中,反应过程中氧气的变化量如图所示,则0~20min平均反应速率v(HCl)为___molL-1·min-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)写出基态Fe2+的核外电子排布式__。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有__和__。1molK4[Fe(CN)6]含有σ键为__mol。
(3)黄血盐中N原子的杂化方式为__;C、N、O的第一电离能由大到小的排序为__,电负性由大到小的排序为__。
(4)Fe、Na、K的晶体结构如图所示:
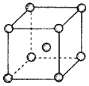
①钠的熔点比钾更高,原因是__。
②Fe原子半径是rcm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是__g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了5种元素在周期表中的位置。
| ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是________,⑤的原结构示意图是________________;
(2)以上元素中,金属性最强的是________________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈________性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是__________(填元素符号);
(5)元素③与元素⑤形成的化合物的名称是________________;
(6)少量元素③的单质通常保存在________中(填“煤油”或“水”);
(7)元素①与元素②的单质氧化性较强的是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是

A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个![]()
B. 晶体中每个K+周围有8个![]() ,每个
,每个![]() 周围有8个K+
周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个,晶体中与每个![]() 距离最近的
距离最近的![]() 有6个
有6个
D. 晶体中其中0价氧和-2价氧的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 将某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 该有机物中必定含有碳碳双键 |
B | 向亚硫酸钠溶液中滴加硝酸钡和稀硝酸 | 产生白色沉淀 | 亚硫酸钠溶液已变质 |
C | 向酸性高锰酸钾溶液中滴加双氧水 | 紫色褪去,产生气泡 | H2O2具有还原性 |
D | 向乙醇溶液中加一小块钠 | 产生气泡 | 乙醇含有羟基 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com