
【题目】二氧化碳的回收利用是环保领域研究热点。
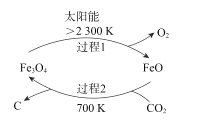
(1)在太阳能的作用下,以CO2为原料制炭黑的流程如图所示。总反应的化学方程式为__;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。
CH3OH+H2O。
已知298K和101kPa条件下:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;
2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
则CH3OH(l)的标准燃烧热ΔH=__;
(3)在催化剂M的作用下,CO2经过催化氢化合成低碳烯烃等。
CO2和H2同时发生下列两个反应:
①2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH<0
CH2=CH2(g)+4H2O(g) ΔH<0
②2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0
CH3OCH3(g)+3H2O(g) ΔH<0
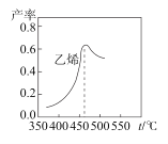
如图是乙烯在相同时间内,不同温度下的产率,当温度高于460℃时乙烯产率降低的原因不可能是__。
A.催化剂M的活性降低
B.①反应的平衡常数变大
C.生成甲醚的量增加
【答案】![]()
![]() B
B
【解析】
(1)从流程图获取信息,在太阳能的作用下,四氧化三铁分解为氧化亚铁和氧气,在700K时,氧化亚铁和CO2反应得到四氧化三铁和炭黑,则据此可获得总反应的化学方程式;
(2)已知298K和101kPa条件下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ/mol;
CH3OH(g)+H2O(l) ΔH=-akJ/mol;
2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;
CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol;
根据盖斯定律计算CH3OH(l)的标准燃烧热ΔH;
(3) 当温度高于460℃时乙烯产率降低的原因从不同角度
A.催化剂M的催化效率对一定条件下乙烯的产率有影响,而催化剂活性与温度关系密切;
B.反应①随温度升高,平衡会移动,反应的平衡常数会改变;
C.生成甲醚的量增加势必会减少乙烯的产率;
据此判断。
(1)从流程图获取信息,过程1的反应为:![]() ,过程2的反应为:在700K时,
,过程2的反应为:在700K时,![]() ,据此可获得总反应的化学方程式为:
,据此可获得总反应的化学方程式为:![]() ;
;
答案为:![]() ;
;
(2)已知298K和101kPa条件下:反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) ΔH=-akJ/mol;反应②:2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;反应③:CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol,根据盖斯定律,则
CH3OH(g)+H2O(l) ΔH=-akJ/mol;反应②:2H2(g)+O2(g)=2H2O(l) ΔH=-bkJ/mol;反应③:CH3OH(g)=CH3OH(l) ΔH=-ckJ/mol,根据盖斯定律,则![]() ②-(①+③)即可得到表明CH3OH(l)的标准燃烧热的热化学方程式:
②-(①+③)即可得到表明CH3OH(l)的标准燃烧热的热化学方程式:![]() ΔH=
ΔH=![]() =
=![]() ;
;
答案为:![]() ;
;
(3) A. 催化剂M的催化效率对一定条件下乙烯的产率有影响,而催化剂活性与温度关系密切,当温度过高,催化剂活性降低;当反应速率降低,单位时间生产效益降低了,产率就降低了,故A可能;
B. 反应①为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g) ΔH<0,随温度升高,平衡会向左移动,反应的平衡常数会变小,B不可能;
CH2=CH2(g)+4H2O(g) ΔH<0,随温度升高,平衡会向左移动,反应的平衡常数会变小,B不可能;
C. 生成甲醚的量增加势必会减少乙烯的产率,C可能;
答案选B。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】根据反应中质子(H+)的转移,可以重新定义酸和碱:酸=质子+(共轭)碱。因此酸碱之间存在彼此的共轭关系:HA+BA-+BH+。关于反应:HC2O4-+H3O+![]() H2C2O4+H2O、HC2O4-+OH-
H2C2O4+H2O、HC2O4-+OH-![]() C2O42-+H2O,下列判断正确的是
C2O42-+H2O,下列判断正确的是
A. HC2O4-的共轭碱为H2C2O4
B. HC2O4-的共轭酸为C2O42-
C. HC2O4-既有酸性又有碱性
D.H3O+是水的共轭碱,H2O是OH-的共轭酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 |
HClO | 3×10-8 |
H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 |
H2S | K1=1.3×10-7 K2=7.1×10-15 |
请回答下列问题:
(1)同浓度的CH3COO-、![]() 、
、![]() 、
、![]() 、ClO-、S2-中结合H+的能力最弱的是_____________。
、ClO-、S2-中结合H+的能力最弱的是_____________。
(2)常温下0.1molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_____________(填字母)。
A.c(H+) B. C.
C.![]() D.c(OH-)
D.c(OH-)
(3)pH相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是CH3COOK_____________NaClO,两溶液中:c(Na+)-c(ClO)_____________c(K+)-c(CH3COO-)(填“>”“<”或“=”)。
(4)向0.1molL-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液pH=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列两个实验的说法正确的是( )

A.若甲中b电极的表面有气泡产生,则b为阳极
B.若甲中a为Zn,b为Cu,则正极附近的SO![]() 离子浓度逐渐增大
离子浓度逐渐增大
C.若乙中c电极为Fe,则电解一段时间后,溶液变浑浊
D.若乙中c、d均为惰性电极,产生22.4LCl2时,则转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(主要成分是MnO2,含有Al2O3、SiO2等杂质),制备KMnO4的流程图如下:

已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性,能发生可逆的歧化反应。
下列说法正确的是
A.向“浸取”后的溶液中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为Al(OH)3
B.“歧化”时,加入冰醋酸是为了调节溶液pH,使3MnO![]() +2H2O
+2H2O![]() 2MnO
2MnO![]() +MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率
+MnO2+4OH-正向移动,促进KMnO4的生成,提高KMnO4的产率
C.“歧化”步骤中调节溶液pH时,可以用浓盐酸来代替冰醋酸
D.“操作II”时,当有大量晶体析出时,利用余热蒸干,即得紫黑色KMnO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关合成氨工业的叙述,能够用勒·夏特列原理来解释的是
A.加入催化剂可以提高单位时间氨的产量
B.高压比常压条件更有利于合成氨的反应
C.500℃高温比室温更有利于合成氨的反应
D.N2和H2按物质的量之比1:2.8混合,更有利于氨的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是应用广泛的有机高分子化合物,其中合成M的一种路线如下(部分反应条件略去):
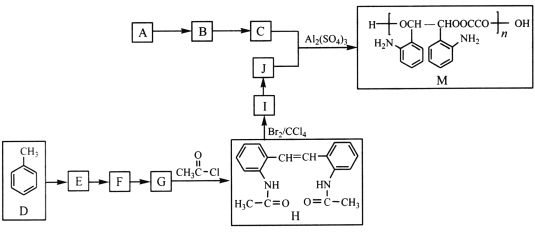
已知:①A的实验式为CH3O。
②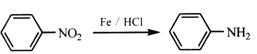 (-NH2容易被氧化)
(-NH2容易被氧化)
③![]()
④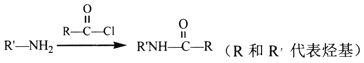
⑤![]()
回答下列问题:
(1)E的化学名称为_____________________________。
(2)H中官能团的名称为____________________________。
(3)D→E、I→J的转化过程中所用试剂和反应条件分别是_________、__________。
(4)C+J→M的化学方程式为_________________________________。
(5)同时满足下列条件的F的同分异构体有______种(不考虑立体异构)。
①含有的官能团与F相同;
②碳架结构与F完全相同;
③两个含氮官能团分别连在两个不同苯环上。
F的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器为_______________(填序号)。
A.元素分析仪 B.红外光谱仪 C.质谱仪 D.核磁共振波谱仪
(6)参照上述合成路线和信息,以A和甲苯为有机原料(无机试剂任选),设计制备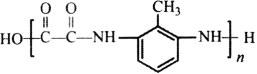 的合成路线。
的合成路线。
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com