
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
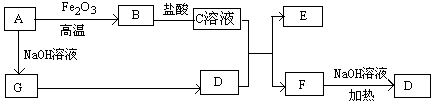
请回答下列问题:
(1)写出F的电子式:
(2)①C溶液与D反应的离子方程式为
②F溶液与NaOH溶液共热反应的化学方程式为
(3)①请用离子方程式解释C溶液为何显酸性
②F溶液中离子浓度由大到小的顺序为
(4)将5.4gA投入200mL 2.0mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是 (填代号)
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1molN2和3molG及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2mol/(L·min),则v(D)= mol/(L·min)
②在其他条件不变的情况下,若起始时充入0.5molN2和1.5molG达到平衡后,D的物质的量浓度 (填“大于”、“小于”或“等于”)a/2 mol/L。
③该条件下的平衡常数为 (用含a的代数式表示)
(1)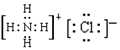
(2)① Al3++ 3NH3·H2O=Al(OH)3↓+3NH4+ ②NH4Cl+NaOH=NaCl+NH3↑+H2O
(3)①Al3++3H2O Al(OH)3+3H+ ②c(Cl-) > c(NH4+)
> c(H+)>c(OH-)
Al(OH)3+3H+ ②c(Cl-) > c(NH4+)
> c(H+)>c(OH-)
(4)D
(5)①0.8 ②小于 ③
【解析】
试题分析:根据题目给定的信息机相应的转化关系可知:A:Al;B:Al2O3;C:AlCl3;D:NH3;E:Al(OH)3;F:NH4Cl;G:H2.(1)氯化铵的电子式略。(2)①C溶液与D反应的离子方程式为:Al3++ 3NH3·H2O=Al(OH)3↓+3NH4+。②F溶液与NaOH溶液共热反应的化学方程式为NH4Cl+NaOH NaCl+NH3↑+H2O。(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O
NaCl+NH3↑+H2O。(3)①AlCl3是强酸弱碱盐。弱碱根离子水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,促使水进行电离。最终溶液中氢离子的浓度大于氢氧根离子的浓度。溶液显示酸性。离子方程式为:Al3++3H2O Al(OH)3+3H+。②NH4Cl发生电离:NH4Cl=NH4++Cl-。由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+)
> c(H+)>c(OH-)。(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。2Al+6H+=2Al3++3H2↑;
2Al+2H2O+2OH-=2AlO2-+ 3H2↑.溶液n(Al)= 5.4g÷27g/mol=0.2mol. 由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3
n(Al)=3×0.2mol=0.6mol.n(酸)=0.2×2mol=0.4mol. n(H+)=a n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属灰完全反应。不成立。所以选项为:D。(5)N2+3H2
Al(OH)3+3H+。②NH4Cl发生电离:NH4Cl=NH4++Cl-。由于NH4+发生水解反应要消耗,所以C(Cl-)>C(NH4+),消耗了水电离产生的OH-离子,最终导致C(H+)>C(OH-)。但盐的水解程度是和微弱的。所以溶液中各离子的浓度大小顺序是:c(Cl-) > c(NH4+)
> c(H+)>c(OH-)。(4)能和Al反应放出H2。则某溶液为酸溶液或强碱溶液。硝酸有强的氧化性,一般和金属发生反应不放出氢气。2Al+6H+=2Al3++3H2↑;
2Al+2H2O+2OH-=2AlO2-+ 3H2↑.溶液n(Al)= 5.4g÷27g/mol=0.2mol. 由于充分反应后金属有剩余,说明酸或碱不足量。若为酸则n(H+)<3
n(Al)=3×0.2mol=0.6mol.n(酸)=0.2×2mol=0.4mol. n(H+)=a n(酸)= 0.4a<0.6mol,所以只能是HCl;若为强碱,则n(OH-)=n(碱)=0.4mol,比Al多,金属灰完全反应。不成立。所以选项为:D。(5)N2+3H2 2NH3。在反应方程式中V(H2):V(NH3)=3:2.
V(H2)= 1.2mol/(L·min),则V(NH3)=2/3 V(H2)=2//3×1.2mol/(L·min)=0.8
mol/(L·min). ②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为a/2 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于a/2
mol/L。③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K=
2NH3。在反应方程式中V(H2):V(NH3)=3:2.
V(H2)= 1.2mol/(L·min),则V(NH3)=2/3 V(H2)=2//3×1.2mol/(L·min)=0.8
mol/(L·min). ②在其他条件不变的情况下,假如平衡不移动,若起始时充入0.5molN2和1.5molG。达到平衡后,D的物质的量浓度为a/2 mol/L。但是根据平衡移动原理:在其它条件不变的情况下,减小反应物的浓度,化学平衡向逆反应方向移动。所以达到平衡后,D的物质的量浓度要小于a/2
mol/L。③化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的乘积与各反应物浓度幂指数的乘积的比。即K= 。
。
考点:考查元素的推断、元素及化合物的性质、外界条件对化学平衡影响的计算等知识。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
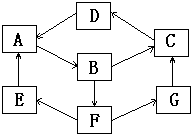 常见的无机物之间有如图所示的转化关系,已知,A、B、C、D、G含有同一种元素,E是通常情况下密度最小的气体,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E和G.相关物质的颜色如下表:
常见的无机物之间有如图所示的转化关系,已知,A、B、C、D、G含有同一种元素,E是通常情况下密度最小的气体,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E和G.相关物质的颜色如下表:| 物质 | 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
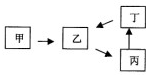 甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).
甲、乙、丙、丁四种物质有如图所示的转化关系,已知甲是地壳中含量最高的元素组成的单质,常见化合物乙、丙、丁均含有短周期一种相同元素(除组成甲的元素外).查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省协作体高三第一次联考理综化学试卷(解析版) 题型:填空题
元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩.
(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。 与铜相比,其金属活泼性?????? (填“强”或“弱”);
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是?????????????????????????? ;
⑶工业上净化处理铬污染方法之一是:将含K2Cr2O7酸性废水放人电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知KsP[ Fe(OH)3]=4.0×10-38,KsP[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为??????????? mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为金属单质。
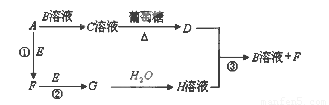
请回答下列问题:
(1)A的电子式为???????? D的化学式?????????? ,C溶液的名称是??????????????????? 。
(2)反应①的化学方程式为?????????????????????????????? ;
反应③的离子方程式为?????????????????????????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com