
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:
[Zn(CN)4]2-+4HCHO+4H2O==Zn2++4HOCH2CN+4OH-,回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
(5)Zn与S形成某种化合物的晶胞如图所示。
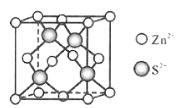
①Zn2+填入S2-组成的___________空隙中;
②已知晶体密度为d g/cm3,该晶胞的边长表达式为______pm(写计算表达式)。
【答案】1s22s22p63s23p63d10(或[Ar]3d10) 4 N>O>C 3:1 sp2 HCHO与水分子间存在氢键 配位键 C 正四面体 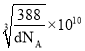
【解析】
(1)Zn位于周期表中第4周期第ⅡB族,C的基态核外电子排布式为1s22s22p2;
(2)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,据此答题,单键为σ键,三键中一根为σ键,两根为π键;
(3)利用甲醛中的成键来分析碳原子的杂化类型,HCHO极易与水互溶,考虑形成氢键;
(4)含有空轨道和含有孤电子对的原子之间易形成配位键,提供孤电子对的成键原子是C原子;
(5)①ZnS和金刚石晶胞的相似性,根据立体几何分析Zn2+在S2-中的填隙方式;
②根据晶体密度公式d=![]() 计算,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积。
计算,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积。
(1)Zn位于周期表中第4周期第ⅡB族,则其基态核外电子排布式为:[Ar]3d10;C的基态核外电子排布式为1s22s22p2,则轨道表达式为![]() ,占据4个不同的原子轨道;
,占据4个不同的原子轨道;
(2)C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;单键为σ键,三键中一根为σ键,两根为π键,HOCH2CN分子中含有的σ键有6个,含有π键数目为2,所以含有的σ键与π键数目之比为3:1;
(3)甲醛分子中含有碳氧双键,1个甲醛分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,则碳原子轨道的杂化类型为sp2杂化,因甲醛中碳原子采取sp2杂化;福尔马林是HCHO的水溶液,HCHO极易与水互溶是因为HCHO与水分子间存在氢键;
(4)含有空轨道和含有孤电子对的原子之间易形成配位键,Zn2+提供空轨道、CN-中C原子提供孤电子对而形成配位键,提供孤电子对的成键原子是C原子;
(5)①ZnS和金刚石晶胞的相似性,S2-形成的是正四面体结构,则Zn2+填在了S2+形成的正四面体空隙中;
②取1mol晶胞,则有NA个晶胞,设晶胞参数为acm,则一个晶胞的体积为V=a3cm3,对于立方晶胞,顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,内部粒子为整个晶胞所有,则一个ZnS晶胞中,含有Zn的数目为8×
,内部粒子为整个晶胞所有,则一个ZnS晶胞中,含有Zn的数目为8×![]() +6×
+6×![]() =4,含有S的数目为4,因此1molZnS的质量为m=4×(65+32)g=388g,已知晶体的密度为dg/cm3,则有d=
=4,含有S的数目为4,因此1molZnS的质量为m=4×(65+32)g=388g,已知晶体的密度为dg/cm3,则有d=![]() =
=![]() g/cm3,解得:a=
g/cm3,解得:a=![]() cm=
cm=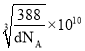 pm。
pm。


科目:高中化学 来源: 题型:
【题目】幸福可以“人工合成”吗?精神病学专家通过实验发现,人体中的一种脑内分泌物多巴胺,可影响一个人的情绪。多巴胺是一种神经递质,用来帮助细胞传送脉冲的化学物质。这种脑内分泌物主要负责大脑的情感,将兴奋及开心的信息传递,使人感到愉悦和快乐。多巴胺可由香兰素与硝基甲烷缩合,再经锌还原水解而得,合成过程如下:
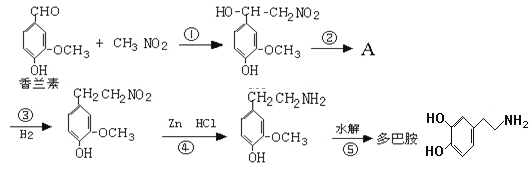
请回答下列问题:
(1)写出香兰素中含有的官能团的名称是___________________。
(2)上述合成过程中属于加成反应的是 (填反应序号)_____________。
(3)反应②的反应条件是__________。有机物A的结构简式为____________。
(4)写出符合下列条件的多巴胺的所有同分异构体的结构简式:_______________。
(i)属于1,3,5-三取代苯 (ii)苯环上直接连有一个羟基和一个氨基
(iii)分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1
(5)多巴胺遇足量浓溴水会产生沉淀,请写出该反应的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2与H2O的反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 铜丝插入Fe2(SO4)3溶液中:Cu +Fe3+ =Cu2+ +Fe2+
C. 向FeBr2溶液中通入过量Cl2:2Br-+Cl2=Br2+2Cl-
D. 向Na2SiO3溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯和苯等化学品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去)。
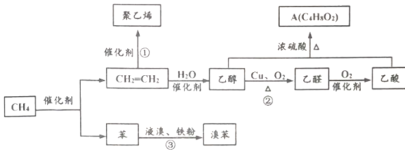
(1) A的结构简式:____________,乙酸中含有的官能团名称为___________
(2)反应③的反应类型为___________。
(3)反应①的化学方程式:____________。
(4)某实验小组用如图所示装置进行反应②实验。
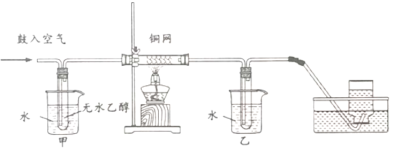
i.在实验过程中,铜网出现红色和黑色交替的实验现象,请写出铜网由黑变红时的化学反应方程式____, 在这个反应中,说明乙醇具有______性(填氧化”、“还原”)
ii.已知:乙醛的沸点为20.8C, 乙醇的沸点为78. 4C.实验装置中甲和乙两个水浴作用不相同,甲的作用是________, 乙的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了5种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ |
(1)①的元素符号是_______,⑤的原子结构示意图是__________;
(2)以上元素中,非金属性最强的是___________(填元素符号);
(3)④元素的最高价氧化物对应的水化物呈______性(填“酸”或“碱”或“两”);
(4)③④⑤三种元素按原子半径由大到小的顺序是______(填元素符号);
(5)元素①与元素②的单质氧化性较强的是________(填化学式)。;
(6)元素④的最高价氧化物与元素③的最高价氧化物对应的水化物相互反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经2min后,测得D的浓度为0.5molL-1,c(A):c(B)=3:4,C的平均反应速率为0.5molL-1min-1。下列说法不正确的是
A.2min后,测得A的转化率为33.3%
B.反应开始前容器中的A、B的物质的量各为4.5mol
C.2min内,用B表示的化学反应速率ν(B)=0.25molL-1min-1
D.x的值为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和钾是极活泼的金属元素,钠和钾及化合物在生产和生活中有广泛的应用。
(1)写出两种可以食用的含钠化合物的化学式:________。将0.01 mol下列物质(①Na2O2;②Na2O;③Na2CO3;④NaCl)分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度由大到小的顺序是(溶液体积变化忽略不计)_______。
(2)由于钾比钠更活泼,制备K2O一般是用单质钾还原对应的过氧化物、硝酸盐或亚硝酸盐,试写出用钾与硝酸钾反应制取K2O的化学方程式(还有一种单质生成):______________________。K2O2也有强氧化性,试写出其与SO2发生反应的化学方程式:_______________________。
(3)某学生用Na2CO3和 KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等且不考虑HCl的挥发)
实验序号 | ① | ② | ③ | ④ |
盐酸体积/mL | 50 | 50 | 50 | 50 |
固体质量/g | 3.06 | 6.12 | 9.18 | 12.24 |
生成气体体积/L(标况) | 0.672 | 1.344 | 1.568 | 1.344 |
根据数据计算所用盐酸的物质的量浓度为__________,原混合物样品中n(Na2CO3)∶n(KHCO3)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)从A.甲烷 B.乙酸 C.乙醇 D.蛋白质等四种有机物中,选择合适的物质,将其标号填在横线上。
①蚕丝的主要成分是__________。
②我国“西气东输”的气体主要成分是____________。
③酒驾是指驾驶员呼出的气体中____________含量超标。
④可清除热水瓶内胆水垢[主要成分CaCO3和Mg(OH)2]的是____________。
(2)A、B、C、D、E均为中学常见有机物,其转化关系如下图,回答下列问题:
![]()
①E物质的结构简式为____________,AB的化学方程式为____________。
②实验室利用A和C制取D,反应的化学方程式为_____,收集装置可选用下图______装置(填标号)。
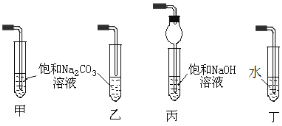
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com