
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
(2)下列反应中属于取代反应的是 。(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
(14分)
Ⅰ.(1)C7H16 (2分) (2)②④ (2分)
Ⅱ.(1)N、S (各1分)
(2)HC2O4-  C2O4- + H+
C2O4- + H+
HC2O4-+H2O H2C2O4 +
OH-
H2C2O4 +
OH-
HC2O4-的电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性(2分)
c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-) (2分)
(3)①(NH4)2Fe(SO4)2·6H2O (2分) ②5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O(2分)
【解析】
试题分析:Ⅰ(1)此题为中档题,其实这道题更象是一个简单的数学题,不需要过多的化学知识,不过学生平时估计也碰到过这种找多少项为什么的类似题。有多种做法,比如我们把它分为4循环,22=4*5+2,也就是说第20项为C6H12O2,接着后面就是第22项为C7H16,这里面要注意的是第一项是从2个碳原子开始的。(2)取代反应是指有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应。Ⅱ(1)A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,可知A为H元素,E为Na元素,B为C元素,C为N元素,D为O元素,F为S元素。(2)A2B2D4为H2C2O4(草酸,弱酸),与等物质的量的KOH溶液反应的方程式为:H2C2O4+KOH=KHC2O4+H2O,溶液中含有HC2O4-,即水解HC2O4-+H2O H2C2O4 +
OH-,也电离HC2O4-
H2C2O4 +
OH-,也电离HC2O4-  C2O4- + H+,电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性,其各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-)。(3)①加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体,可推知Z中含有NH4+;白色沉淀迅速变为灰绿色,最终变为红褐色,可推知Z中含有Fe2+;加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,可推知Z中含有SO42-,结合化合物Z(相对分子质量为392),1molZ中含有6mol结晶水,可得Z的化学式为(NH4)2Fe(SO4)2·6H2O。②KMnO4溶液(硫酸酸化)具有强氧化性,把Fe2+氧化成Fe3+,其离子方程式为:5Fe2+
+ MnO4- + 8H+ = 5Fe2+ + Mn2+
+ 4H2O。
C2O4- + H+,电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性,其各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-)。(3)①加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体,可推知Z中含有NH4+;白色沉淀迅速变为灰绿色,最终变为红褐色,可推知Z中含有Fe2+;加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,可推知Z中含有SO42-,结合化合物Z(相对分子质量为392),1molZ中含有6mol结晶水,可得Z的化学式为(NH4)2Fe(SO4)2·6H2O。②KMnO4溶液(硫酸酸化)具有强氧化性,把Fe2+氧化成Fe3+,其离子方程式为:5Fe2+
+ MnO4- + 8H+ = 5Fe2+ + Mn2+
+ 4H2O。
考点:有机反应 电离平衡 水解反应 化学计算
点评:酸式盐显酸性的,常见的只有这几个:硫酸氢盐、亚硫酸酸氢盐、磷酸二氢盐、草酸氢盐。把这几个记住就行了,其它的都是碱性的。


科目:高中化学 来源: 题型:
( 14分 )苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知:

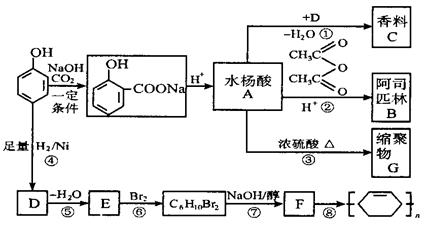
( 1 ) 写出C的结构简式 ___________________ 。
( 2 ) 写出反应②的化学方程式 __________________________ 。
( 3 ) 写出G的结构简式 _________________ 。
( 4 ) 写出反应⑧的化学方程式 ___________________________________ 。
( 5 ) 写出反应类型: ④ ______________ , ⑦ _____________________ 。
( 6 ) 下列可检验阿司匹林样品中混有水杨酸的试剂是 __________________________ 。
a. 三氯化铁溶液 b. 碳酸氢钠溶液 ?c. 石?蕊试液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市金山中学高二10月月考化学试卷(带解析) 题型:填空题
(14分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O HCl+HClO,写出该反应化学平衡常数的表达式
HCl+HClO,写出该反应化学平衡常数的表达式
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2 (g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2 (g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源:2012届河北省石家庄市高三第二次模拟理科综合化学试卷(带解析) 题型:填空题
(14分)甲、乙、丙均为可溶于水的固体,可能含有的离子如下表所示:
已知:
①甲、乙的水溶液均呈碱性,丙的水溶液呈酸性;
②取一定量甲、乙、丙固体混合物,加足量水溶解,最终得到无色澄清溶液;
③向②中所得溶液逐滴加人盐酸至过量,开始无沉淀,后有沉淀生成,继续滴加沉淀消失,过程中有无色无味气体逸出;
④向丙溶液中滴加BaCl2溶液,有白色沉淀生成;
⑤将甲溶液与丙溶液混合,生成白色沉淀和无色气体。
(1) 甲、乙、丙的化学式分别为____________
(2) 250C时,PH均为12的甲溶液和乙溶液中,由水电离出来的c(OH-)之比为______。
(3) 写出⑤中发生反应的离子方程式____________
(4) 250C时,将a mol/L CH3COOH溶液与0.02 mol/L乙溶液等体积混合,所得溶液呈中性,则混合溶液中c(CH3COO-)="______" (忽略混合时溶液体积的变化)。
(5) 等物质的量浓度的乙溶液和丙溶液混合充分反应后,沉淀中的金属元素与溶液中该
元素的质量相等,则乙溶液和丙溶液的体枳比可能为______ (填选项字母)。
| A.3:1 | B.1:3 | C.7:1 | D.1:7 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南西平县高二上学期10月月考化学试卷(带解析) 题型:填空题
(14分)用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1)用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl的pH 7(填“<”、“=”或“>”),显 性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为 ;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为 。
(3)若对NH4Cl溶液进行测定,溶液中浓度最大的是 离子,微粒个数最少的是 离子。
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol。
②_ __和_ 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省杭州市高三上学期期中七校联考化学试卷(解析版) 题型:填空题
(14分)合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。
①图A中氨气的体积分数为15%时,H2的转化率为 。
②图B中T=450℃,则温度为500℃时对应的曲线是 (填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)  CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g)
△H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
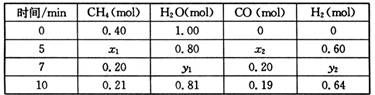
①分析表中数据,判断5 min时反应是否处于平衡状态? (填“是”或“否”),前5 min反应的平均反应速率v(CH4)= 。
②该温度下,上述反应的平衡常数K= 。
③反应在7~10 min内,CO的物质的量减少的原因可能是 (填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在下列坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线。
a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com