
按如图所示装置进行有关实验,拔掉A的玻璃塞,将A溶液逐滴加入B中。
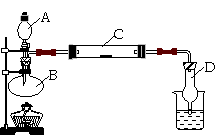
试回答:
(1)A仪器的名称是 ;
怎样检验装置的气密性 ;
(2)若A中为浓盐酸,B中为二氧化锰,C中为淀粉KI试纸,则C中可以观察到的实验现象为 ;
(3)装置D的作用是________________________。
科目:高中化学 来源: 题型:
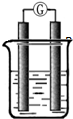 某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验
某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
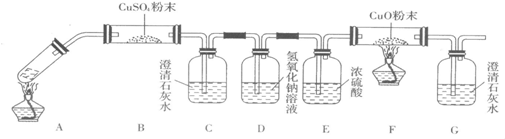
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
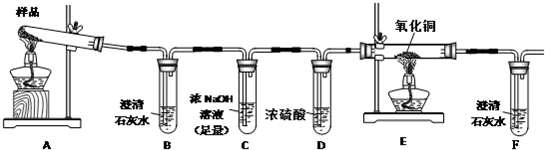
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解.分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体. | 固体产物部分溶解. |
| 步骤2:向试管中加入适量 CuSO4 CuSO4 溶液,再加入少量不溶固体,充分振荡. |
(1)若溶液颜色及加入的不溶固体无明显变化,则假设 2 2 成立.(2)若溶液颜色明显改变,且有 暗红 暗红 色固体生成,则证明有铁单质 铁单质 存在 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量 HCl HCl ,静置,取上层清液,滴加适量KSCN KSCN ,充分振荡后滴加H2O2 H2O2 . |
结合步骤2中的(2): (1)若溶液基本无色,则假设 1 1 成立(2)若溶液呈血红色,则假设 3 3 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
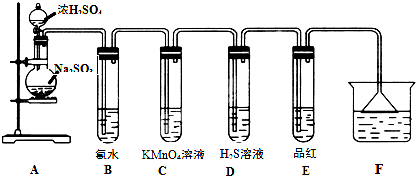
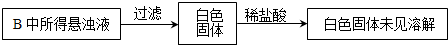
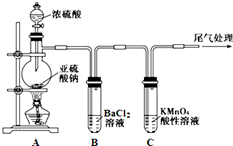 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com