
科目:高中化学 来源: 题型:阅读理解
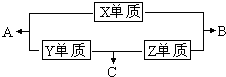 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
| ||
| △ |
| ||
| △ |
| 加热 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z |
| 甲 | 乙 | 丙 |


查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市浦东新区高三下学期二模化学试卷(解析版) 题型:填空题
化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式 ,该分子属
于 (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式: 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
查看答案和解析>>
科目:高中化学 来源:河南省期末题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)根据元素周期表1―20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有 种,金属性最强的元素单质与氧气反应生成的化合物有 (填两种化合物的化学式)。
(2)属于稀有气体的是 (填写元素符号,下同)。
(3)形成化合物种类最多的两种元素是 。
(4)第三周期中,原子半径最大的是(稀的气体除外) 。
(5)推测Si、N最简单氢化物的稳定性 大于 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com