
用惰性电极电解饱和食盐水,下列说法正确的是
A.电解过程中, Cl-向阳极方向移动,发生还原反应
B.电解一段时间后,阴极附近溶液pH增大
C.电解池中的总反应为:2H++2Cl-=H2↑+Cl2↑
D.欲使电解池中的溶液恢复到电解前状态,应加入适量浓盐酸
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源:2016-2017学年甘肃省定西市通渭县高二上学期期末化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.二氧化硫溶于水能导电,故二氧化硫属于电解质
B. 硫酸钡难溶于水,故硫酸钡属于弱电解质
硫酸钡难溶于水,故硫酸钡属于弱电解质
C.硫酸是强电解质,故纯硫酸能导电
D.氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一12月月考化学卷(解析版) 题型:选择题
某物质灼烧时,焰色反应为黄色,下列判断正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠 D.该物质中不可能含有钾元素
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一12月月考化学卷(解析版) 题型:选择题
下列反应中,水作为氧化剂的是
A.2Na+2H2O=2NaOH+H2↑ B.Cl2+H2O=HCl+HClO
C.2F2+2H2O=4HF+O2 D.SO2+H2O=H2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期末化学卷(解析版) 题型:实验题
某同学欲用已知浓度的NaOH溶液滴定未知浓度的CH3COOH溶液,请填写下列空白:
(1)用洁净的 式滴定管量取待测液10.00 mL,并转移至锥形瓶中。
(2)以下是几种酸碱指示剂变色的pH范围:
①甲基橙3.1~4.4;②石蕊5~8;③酚酞8.2~10,上述指示剂应选择 。
(3)用标准NaOH溶液滴定待测CH3COOH溶液时,左手控制滴定管阀门,右手不停地摇动锥形
瓶,两眼注视 。当 时,即达到滴定终点。
(4)下列操作,会使所测CH3COOH溶液浓度偏高的是:
A.用于量取待测液的滴定管洗涤后未用待测液润洗。
B.盛装待测液的锥形瓶洗涤后,残留有蒸馏水。
C.滴 定时,滴定管尖端处有气泡,滴定完毕排出气泡。
定时,滴定管尖端处有气泡,滴定完毕排出气泡。
D.在滴定过程中,摇动锥形瓶时,因用力过猛,使少量溶液溅出。
E.滴定前读数时俯视,滴定完毕读数时仰视。
(5)当达滴定终点时,锥形瓶中溶液呈 性(填“酸”“碱”或“ 中”),其原因是:____________(用离子方程式表示)。
中”),其原因是:____________(用离子方程式表示)。
(6)在0.1 mol·L-1的CH3COONa溶液中,下列粒子浓度关系式正确的是 。
A.c(Na+)>c(CH3COO-)>c(H+)> c(OH-)
c(OH-)
B.c(OH-)=c(H+)+c(CH3COO-)
C.c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.1m ol·L-1
ol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市部分区高一上学期期末化学试卷(解析版) 题型:实验题
完成下列问题
Ⅰ.某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验:
①取少量KI溶液于试管中,先加入溴水,振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
②取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈血红色。
(1)写出实验②中发生氧化还原反应的离子方程式:__________________。
(2)由上述两个实验,对物质氧化性可以得出的正确结论是__________。
A. Br2>I2 B. Fe3+>Br2 C. Br2>Fe3+ D. I->Br-
Ⅱ.被誉为“江南小三峡”的南京胭脂河是明代初年开凿的一条人工运河。因其“石有胭脂色”而得名。胭脂河沿岸的那些红色石块的成分是什么?某研究性学习小组取一小块这种红色石块A,粉碎后对其成分进行实验探究,实验记录如下图所示。

请你根据实验推断:
(1)A中含有的酸根离子__________________(写离子符号)。
B中肯定含有的溶质是_____________________(写化学式)。
(2)写出实验中有关反应的化学方程式:
②_________________________________;
⑤_________________________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市部分区高一上学期期末化学试卷(解析版) 题型:选择题
在硫酸铁溶液中,加入ag铜完全溶解后再加入bg铁,充分反应后得到cg残余固体,且a>c,则下列说法中正确的是
A.残余固体可能为铁和铜的混合物
B.最后得到的溶液可能含有Fe3+
C.残余固体是铁,溶液中一定不含Cu2+
D.残余固体全部是铜
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市部分区高二上学期期末化学试卷(解析版) 题型:填空题
根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
2Fe(s)+3CO2(g) ∆H=-28.5kJ/mol
冶炼铁反应的平衡常数表达式K=____________,
温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)己知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g) ∆H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g) 2Fe(s)+3
2Fe(s)+3 CO2(g) ∆H2=-28.5kJ/mol
CO2(g) ∆H2=-28.5kJ/mol
③C(石墨)+ CO2(g)=2CO(g) ∆H3=akJ/mol
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。(已知 =4)
=4)
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为___________。
②下列情况标志反应达到平衡状态正确的 是________(填字母)。
是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
(4)一定条件下发生反应:N2(g)+ 3H2(g) 2NH3(g)∆H<0。
2NH3(g)∆H<0。
① 在某温度时,向容积固定的容器中加入1mol N2和3mol H2,达到平衡后:
a.若向容器中通入N2,则N2的转化率将___________(填“增大”、“减小”或“不变”,下同)。
b.若再通入1mol N2和3mol H2,氮气的转化率将________。
②三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨气的体积分数随时间变化如图,下列说法正确的是___________。
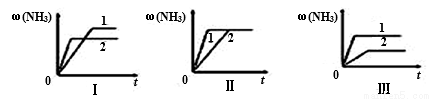
a.图Ⅰ可能是不同温度对反应的影响,且T1>T2
b.图Ⅱ可能是同温同压下有无催化剂, 1表示没加入催化剂, 2表示加入了催化剂
c.图Ⅲ可能是不同压强对反应的影响,且p1>p2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省资阳市高一上学期期末化学试卷(解析版) 题型:选择题
若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,混合气体中一氧化碳和二氧化碳的物质的量之比是
A.1∶3 B.3∶1 C.2∶1 D.1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com