
常温下,将0.1 mol的金属钠、镁、铝分别投入到100 mL 0.5 mol/L的盐酸中,完全反应后产生的氢气是( )
A.镁、铝一样多 B.钠放出的多
C.镁放出的多 D.铝放出的多
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:021
|
下列有关电解质溶液中微粒的物质的量浓度关系正确的是 | |
A. |
常温下,将0.1 mol·L-1 NH4Cl溶液与0.05 mol·L-1 NaOH溶液等体积混合:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
B. |
常温下,向CH3COOH溶液中加入适量的NaOH,得到pH=4的混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
C. |
浓度均为0.1 mol·L-1的Na2CO3溶液和NaHCO3溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) |
D. |
常温下,pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(X-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
①混合溶液中由水电离出的c(H+)__________0.2 mol·L-1 HCl溶液中由水电离出的c(H+);(填“>”“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)= __________mol·L-1;
c(H+)-c(MOH)= __________ mol·L-1。
(2)常温下若将0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”“<”或“=”=
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”“<7”或“无法确定”)
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省沈阳市高二上教学质量监测化学试卷(解析版) 题型:填空题
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH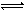 CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系
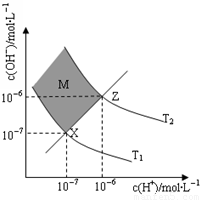
①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省高二上学期期中考试化学试卷 题型:填空题
(8分)常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________mol/L;c(H+)-c(MOH)=________mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度______MCl的水解程度。(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com