
【题目】格列本脲是一种降糖及利尿的药物,一种合成格列本脲的路线如图:

已知:(1)![]() (2)
(2)![]()
回答下列问题:
(1)B含有的官能团名称是_______,D的名称是__________。
(2)H的结构简式为__________。
(3)写出下列反应的反应类型:⑥__________,⑨__________。
(4)写出E与CH3I反应的化学反应方程式__________。
(5)符合下列要求的E的同分异构体有__________种。
①具有酯基、能发生银镜反应 ②遇FeCl3溶液显紫色
(6)以甲苯和![]() 为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(
为原料,其他无机试剂自选,参照上述格列本脲的合成路线,设计一条制备甲磺丁脲(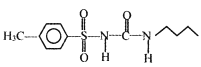 )的合成路线_____________.
)的合成路线_____________.
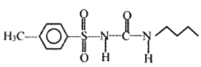
【答案】氯原子 、羧基 邻羟基苯甲酸 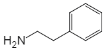 取代反应 加成反应
取代反应 加成反应  +CH3I
+CH3I +HI 10
+HI 10 ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
根据A生成B的反应条件可知A发生氧化反应生成B,则A中与苯环相连的碳原子上有氢原子;B中氯原子水解生成酚羟基,酚羟基和羧基再与NaOH反应生成C,C酸化得到D,D中苯环上的氢原子被氯原子取代生成E,根据F的结构简式可知取代的是酚羟基对位的氢原子,所以E为 ;E与CH3I发生取代反应(酚羟基的氢原子被甲基取代)之后再与SOCl2发生取代反应(羧基中的羟基被氯原子取代)生成F,F与H发生类似信息(2)的反应生成I,根据I的结构简式和该反应的机理可知H为
;E与CH3I发生取代反应(酚羟基的氢原子被甲基取代)之后再与SOCl2发生取代反应(羧基中的羟基被氯原子取代)生成F,F与H发生类似信息(2)的反应生成I,根据I的结构简式和该反应的机理可知H为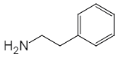 ;I再与ClSO3H发生取代反应生成J,J与NH3发生取代反应生成K,K再与
;I再与ClSO3H发生取代反应生成J,J与NH3发生取代反应生成K,K再与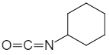 发生加成反应生成格列本脲。
发生加成反应生成格列本脲。
(1)根据B的结构简式可知其含有的官能团为氯原子、羧基;D的名称应为邻羟基苯甲酸;
(2)F与H发生类似信息(2)的反应生成I,根据I的结构简式和该反应的机理可知H为 ;
;
(3)反应⑥中F中—COCl中的氯原子被其他原子团代替,所以为取代反应;
反应⑨中 的碳氮双键被加成,所以为加成反应;
的碳氮双键被加成,所以为加成反应;
(4)E与CH3I反应时F中酚羟基的氢原子被甲基取代,化学方程式为 +CH3I
+CH3I +HI;
+HI;
(5)E分子式为C7H5O3Cl,其同分异构体满足①具有酯基、能发生银镜反应,则含有—OOCH结构,②遇FeCl3溶液显紫色,则含有酚羟基,所以其同分异构体苯环上含有三个不同的官能团,分别为—OOCH、—OH、—Cl,采用定二移一的方法讨论,当—OOCH和—OH处于邻位时,苯环上其余四个氢原子环境各不相同,所以此时有4种;当—OOCH和—OH处于间位时,苯环上其余四个氢原子环境各不相同,所以此时也有4种;当—OOCH和—OH处于对位时,结构对称,此时只有2种,则共有4+4+2=10种同分异构体;
(6)根据格列本脲的合成路线可知 可以由
可以由![]() 和
和![]() 发生加成反应生成,根据I到K的转化过程可知
发生加成反应生成,根据I到K的转化过程可知![]() 可以先和ClSO3H发生取代反应生成
可以先和ClSO3H发生取代反应生成![]() ,再与NH3发生取代反应生成
,再与NH3发生取代反应生成![]() ,所以合成路线为
,所以合成路线为![]()
![]()
![]()
![]()
![]()
![]()
 。
。


科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/LNaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、_______以及等质量的两片纸片。
(2)计算。配制该溶液需取NaCl晶体_______g。
(3)配置过程。
①天平调零。
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
④溶解、冷却,该步实验中需要使用玻璃棒,目的是________。
⑤转移、洗涤。在转移时应使用_____引流,需要洗涤烧杯2-3次是为了______。
⑥定容、摇匀。
⑦将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(4)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“高”、“偏低”或“无影响”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断下列有关说法正确的是( )
A.羰基硫属于非极性分子B.羰基硫的电子式为![]()
C.羰基硫的沸点比CO2低D.羰基硫分子中三个原子处于同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述不正确的是( )

A.简单氢化物的稳定性:X>YB.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为弱酸D.该化合物中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中NOx、SO2等污染物的有效去除和资源的充分利用是当今社会的重要研究课题,目前采用的方法如下:
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
用![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
![]()
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393kJ·mol-1、283kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________________________。
②为研究上述反应,某学习小组在密闭容器中充入10molCO和10molNO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如图。

a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的________________________点。
b.当压强为10MPa、温度为T时的平衡常数Kp=________________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留3位有效数字)。
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:

①该反应的正反应为________________________(填“吸热”或“放热”)反应。
②350℃时,反应达到平衡后向恒容容器中再充入0.100molNO,再次达到平衡后,N2的体积分数应为________________________。
A.0.5B.0.25C.介于0.25和0.5之间D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:
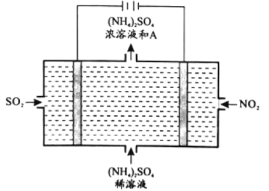
①阴极的电极反应式为________________________。
②上图中A物质是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图进行实验,探究H2O2的分解反应。
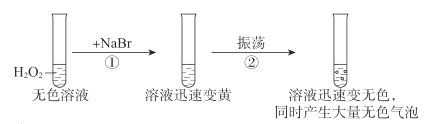
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是
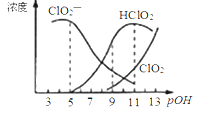
A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (甲)、
(甲)、![]() (乙)、
(乙)、![]() (丙)的分子式均为C8H8,下列说法正确的是
(丙)的分子式均为C8H8,下列说法正确的是
A. 甲的同分异构体只有乙和丙两种 B. 甲、乙、丙均可与溴的四氯化碳溶液反应
C. 甲、乙、丙的二氯化物种数最少的是丙 D. 甲中所有原子一定处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com