
【题目】某二次电池充放电时总反应可表示为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
Fe(OH)2+2Ni(OH)2,下列说法正确的是( )
A.该电池可用H2SO4溶液作电解液
B.放电时,当有1molFe(OH)2生成时,电解质溶液中通过的电子数为2NA
C.放电时,Fe所在的电极发生还原反应
D.充电时,阳极的电极反应式为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
科目:高中化学 来源: 题型:
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
Be | 4 | 89 | 9.32 |
Mg | 12 | 136 | 7.644 |
Ca | 20 | 174 | 6.111 |
Sr | 38 | 191 | 5.692 |
Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为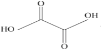 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
名称 | 化学式 | 相对子质量 | 熔点 |
草酸 | H2C2O4 | 90 | 101℃ |
液溴 | Br2 | 160 | -7.2℃ |
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M(如图所示)可用于制备各种高性能防腐蚀涂料。W、X、Y、Z是原子序数依次增大的短周期主族元素,且占据三个不同周期,W与Z的质子数之和是X的2倍。下列说法不正确的是
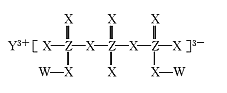
A.原子半径:Y>Z>X
B.X元素的族序数是Y元素的2倍
C.工业上电解熔融Y2X3化合物制备单质Y
D.W与X形成的所有化合物都只含极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2L CO2中含有的共用电子对数为NA
B.2g由D2O与 20Ne组成的混合气体中含有的质子数为NA
C.常温下, 27g铝投入足量的浓硫酸中,生成的SO2分子数为NA
D.100mL 1mol·L1 FeCl3溶液中所含Fe3+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.T℃时,pH=7的溶液一定呈中性
B.已知反应2NO2(g)![]() N2O4(g)在低温下可自发进行,则△H>0
N2O4(g)在低温下可自发进行,则△H>0
C.在0.1molL-1的NH4Cl溶液中:c(NH4+)+c(NH3H2O)=0.1molL-1
D.在Na2CO3溶液中:c(Na+)=2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,向装有5mL0.005mol.L-1FeCl3溶液的试管中加入5mL0.01mol·L-1KSCN溶液,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
A.升高温度,逆反应速率减小
B.加入Fe2(SO4)3固体,溶液血红色加深
C.加入KCl固体,溶液血红色加深
D.增大压强,溶液血红色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸钠(Na2HPO3)溶液电渗析法制备 H3PO3(亚磷酸)的原理如图所示,下列有关说法不正确的是
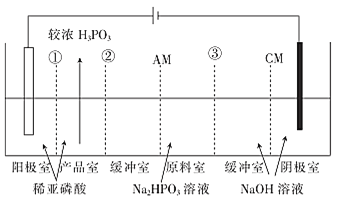
CM:阳离子交换膜,只允许阳离子透过
AM:阴离子交换膜,只允许阴离子透过
A.膜①、②、③均为CM
B.阴极的电极反应式为2H2O+2e-= 2OH- +H2↑
C.阳极的电极反应式为2H2O-4e-= 4H+ +O2↑
D.在原料室与产品室间设计缓冲室的主要目的是提高产品的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,两种碳酸盐MCO3(M分别为A和B两种离子)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M2+),p(CO32-)=-lg c(CO32-)。ACO3比BCO3溶解度更大。(不考虑阴阳离子的水解)。下列说法正确的是
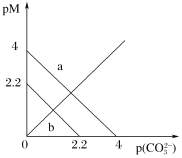
A.线b表示BCO3的溶解平衡曲线
B.该温度下,向ACO3的饱和溶液中加入Na2CO3溶液,一定能产生沉淀
C.t ℃时,ACO3(s)+B2+(aq)![]() BCO3(s)+A2+(aq)平衡常数K=10 0.9
BCO3(s)+A2+(aq)平衡常数K=10 0.9
D.向0.1 L 1 mol/L的BCl2溶液中加入Na2CO3固体,当加入Na2CO3固体的质量为116.6 g时,B2+离子恰好沉淀完全(当B2+离子浓度为10-5 mol/L时认为沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;
元素原子的最外层电子未达到8电子稳定结构,工业上通过分离液态空气获得其单质;![]() 元素原子最外电子层上
元素原子最外电子层上![]() 、
、![]() 电子数相等;
电子数相等;![]() 元素的
元素的![]() 价阳离子的核外电子排布与氖原子相同;
价阳离子的核外电子排布与氖原子相同;![]() 元素原子的
元素原子的![]() 层有1个未成对的
层有1个未成对的![]() 电子。下列有关这些元素性质的说法一定正确的是( )
电子。下列有关这些元素性质的说法一定正确的是( )
A.![]() 元素的简单氢化物的水溶液显碱性
元素的简单氢化物的水溶液显碱性
B.![]() 元素的离子半径大于
元素的离子半径大于![]() 元素的离子半径
元素的离子半径
C.![]() 元素的单质在一定条件下能与
元素的单质在一定条件下能与![]() 元素的单质反应
元素的单质反应
D.![]() 元素的最高价氧化物在常温下不是气态
元素的最高价氧化物在常温下不是气态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com