
【题目】
19-Ⅰ
下列叙述正确的有_______。
A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7
B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能
C.高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性
D.邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点
19-Ⅱ
ⅣA族元素及其化合物在材料等方面有重要用途。回答下列问题:
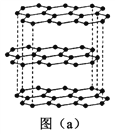
(1)碳的一种单质的结构如图(a)所示。该单质的晶体类型为___________,原子间存在的共价键类型有________,碳原子的杂化轨道类型为__________________。

(2)SiCl4分子的中心原子的价层电子对数为__________,分子的立体构型为________,属于________分子(填“极性”或“非极性”)。
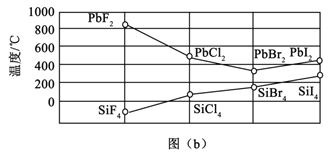
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图(b)所示。
①SiX4的沸点依F、Cl、Br、I次序升高的原因是_________________。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性_______、共价性_________。(填“增强”“不变”或“减弱”)
(4)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示。K位于立方体的棱上和立方体的内部,此化合物的化学式为_______________;其晶胞参数为1.4 nm,晶体密度为_______g·cm-3。
【答案】 AD 混合型晶体 σ键、π键 sp2 4 正四面体 非极性 均为分子晶体,范德华力随分子相对质量增大而增大 减弱 增强 K3C60 2.0
【解析】I.A、某元素原子核外电子总数是最外层电子数的5倍,此元素是Br,位于VIIA族,最高正价为+7价,故A正确;B、金属钠比镁活泼,容易失去电子,因此钠的第一电离能小于Mg的第一电离能,Na最外层只有一个电子,再失去一个电子,出现能层的变化,需要的能量增大,Mg最外层有2个电子,因此Na的第二电离能大于Mg的第二电离能,故B错误;C、HClO4可以写成(HO)ClO3,HClO写成(HO)Cl,高氯酸的中非羟基氧多于次氯酸,因此高氯酸的酸性强于次氯酸,但高氯酸的氧化性弱于次氯酸,故C错误;D、邻羟基苯甲醛形成分子内氢键,降低物质熔点,对羟基苯甲醛形成分子间氢键,增大物质熔点,因此邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点,故D正确;II.(1)该单质为石墨,石墨属于混合型晶体,层内碳原子之间形成σ键,层间的碳原子间形成的是π键;石墨中碳原子有3个σ键,无孤电子对,因此杂化类型为sp2;(2)SiCl4中心原子是Si,有4个σ键,孤电子对数为(4-4×1)/2=0,价层电子对数为4,空间构型为正四面体;属于非极性分子;(3)①SiX4属于分子晶体,不含分子间氢键,范德华力越大,熔沸点越高,范德华力随着相对质量的增大而增大,即熔沸点增高;②同主族从上到下非金属性减弱,得电子能力减弱,因此PbX2中化学键的离子型减弱,共价型增强;(4)根据晶胞的结构,C60位于顶点和面心,个数为8×1/8+6×1/2=4,K为与棱上和内部,个数为12×1/4+9=12,因此化学式为K3C60,晶胞的质量为![]() g,晶胞的体积为(1.4×10-7)3cm3,根据密度的定义,则晶胞的密度为2.0g/cm3。
g,晶胞的体积为(1.4×10-7)3cm3,根据密度的定义,则晶胞的密度为2.0g/cm3。


科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。
(4)298 K时,将20 mL 3x mol·L1 Na3AsO3、20 mL 3x mol·L1 I2和20 mL NaOH溶液混合,发生反应:AsO33(aq)+I2(aq)+2OH![]() AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
AsO43(aq)+2I(aq)+ H2O(l)。溶液中c(AsO43)与反应时间(t)的关系如图所示。
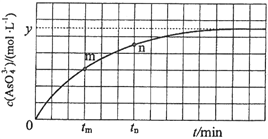
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I)=2v(AsO33)
c. c (AsO43)/c (AsO33)不再变化
d. c(I)=y mol·L1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的电荷数和配位数( )
A.Cu2+、NH3、2+、2B.Cu+、NH3、1+、4
C.Cu2+、OH-、2+、2D.Cu2+、NH3、2+、4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学计算的核心:
(1)相同物质的量的NH3和H2S的质量比___,分子个数比为___,同温同压下的体积比__,所含氢原子的个数比为____.
(2)现有m g某气体,它的一个分子由四原子构成,它的摩尔质量为M g/mol.设阿伏伽德罗常数为NA,则:
①该气体的物质的量为____mol.
②该气体中所含的原子总数为____个.
③该气体在标准状况下的体积为___L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请回答下列问题:
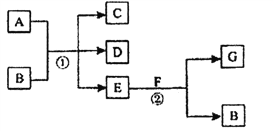
(1)A、G的化学式分别为_______________、________________。
(2)写出A与Fe反应的化学方程式___________________ 。
(3)写出反应②的化学方程式______________________。
(4)己知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。
①将A通入紫色石蕊试液中,观察到的现象是________________;请写出A与水反应的化学方程
式 。
②A与石灰乳反应制得的漂白粉的有效成分是_________(填化学式);该物质在空气中失效的原因______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯与液溴制取溴苯:
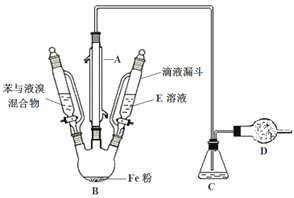
(1)装置A的名称是 _____________________________。
(2)制取溴苯的化学反应方程式 _____________________________。
(3)反应时,装置B中出现的现象有 _________________________。
(4)装置C中导管位置为什么不能伸入液面以下,请解释原因 _____________________。
(5)装置D的作用是 _____________________ 。
(6)反应结束后,将滴液漏斗中的溶液E加入到烧瓶B中,充分振荡后可除去溴苯中的溴,溶液E是 _______________。液体经过分液,所得的溴苯中还含有少量苯,如何进行分离?________(备选答案:过滤/萃取/蒸馏/重结晶)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源可以获得很多物质,如从海水中得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水,等等。
Ⅰ.从海水中得到的粗食盐水常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,可能用到其中几种试剂:①盐酸;②K2CO3;③Na2CO3;④NaOH;⑤Ba(NO3)2;⑥BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。
(1)除去Ca2+、Mg2+过程中发生反应的离子方程式为__________、________。
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________________。
A.先加NaOH,后加Na2CO3,再加BaCl2
B.先加BaCl2,后加NaOH,再加Na2CO3
C.先加K2CO3,后加NaOH,再加Ba(NO3)2
D.先加Ba(NO3)2,后加K2CO3,再加NaOH
E.先加Ba(NO3)2,后加Na2CO3,再加NaOH
(3)判断除去Mg2+的试剂已经足量的方法是__________________________________。
Ⅱ.现有如下图仪器,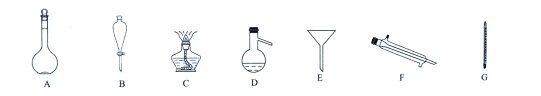
(1)过滤沉淀时必须用到_______(填字母),仪器F的名称是________。
(2)海水蒸馏是由海水获得淡水的常用方法之一,在实验室组成一套蒸馏装置肯定需要所给仪器中的一部分,按照实验仪器由下到上、从左到右的顺序,这些仪器依次是_______________(填字母)。
(3)海带等海藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要所给仪器中的________(填字母),该仪器名称为________,向该碘水中加入四氯化碳以提取碘单质的实验操作称为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com