
| 0.1mol/L×0.0199L |
| 0.02L |


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
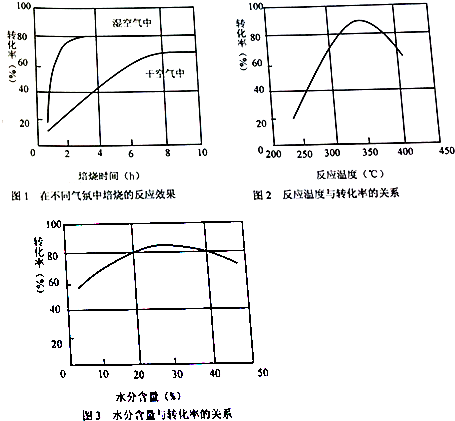
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 样品的质量/g | KmnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA |
| C、已知某种元素的一种原子的质量为 a g,则该元素的相对原子质量近似为a NA |
| D、78 g苯中含有C═C双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
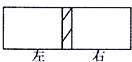 离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和科研中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③均是氧化还原反应 |
| B、氧化性强弱顺序:K2Cr2O7>Fe2(SO4)3>I2 |
| C、反应②中1mol还原剂失去电子数为6.02×1023 |
| D、反应③中氧化剂与还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1-2.25a% |
| B、2.25a% |
| C、1-1.75a% |
| D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥ | B、①④⑤ |
| C、③④ | D、②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、若已知参加反应的Zn的质量,则该装置可用来测定气体摩尔体积 |
| C、若已知参加反应的Zn的质量,则该装置可用来测定锌的相对原子质量 |
| D、反应停止后,立即读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com