
【题目】下列有关钠的化合物说法正确的是( )
A. 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
B. 用加热法除去NaHCO3固体中混有的Na2CO3
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,一定没有K+
D. Na2O2可用于呼吸面具中氧气的来源
科目:高中化学 来源: 题型:
【题目】常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是
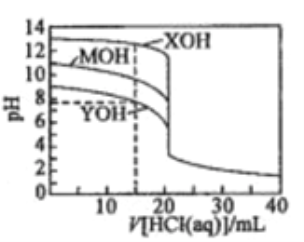
A. XOH为强碱,MOH、YOH均为弱碱
B. V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH
C. V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH
D. V[HCl(aq)]=40.00ml.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是制备治疗高血压药物纳多洛尔的中间体,实验室由A制备G的一种路线如下:
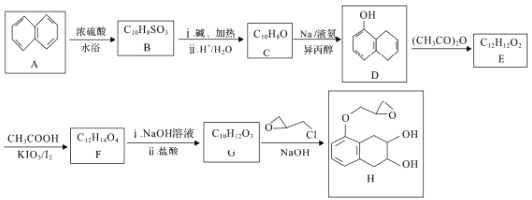
已知:![]()
(1)A的化学名称是________________。
(2)H中所含官能团的名称是____________;有G生成H的反应类型是__________。
(3)C的结构简式为__________,F的结构简式为______________。
(4)由D生成E的化学方程式为___________________________。
(5)芳香族化合物X是F的同分异构体,1molX最多可与4molNaOH反应,其核磁共振氢谱显示分子中有3种不同化学环境的氢,且峰面积比为3:3:1,写出两种符合要求的X的结构简式:___________________________。
(6)写出以甲苯和(CH3CO)2O为原料(其他无机试剂任选)制备化合物![]() 的合成路线:_____________________________________________。
的合成路线:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
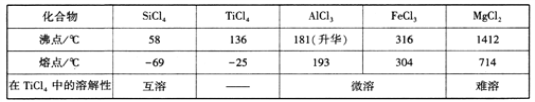
(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。
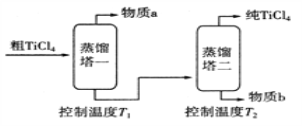
①物质a是__________________(填化学式)。
②T1应控制在______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)Al与NaOH溶液能够形成原电池,写出该电池的负极反应式________。Al的原子结构示意图为_______。不能电解A1的氯化物来生产Al,原因是________;
(2)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上用HF、Na2CO3和A1(OH)3制备冰晶石。写出制备冰晶石的化学方程式________。上述反应不能在玻璃容器中反应,其原因是__________(用化学方程式表示)。
(3)明矾[KA1(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式_______________。
(4)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生气体体积相等(同温同压)。则该合金中铁、硅的质量之比为________(已知:Si+2NaOH+H2O=Na2SiO3+2H2↑)
(5)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。
①写出化学方程式_____________;
②在化学上,含包还原剂的还原能力用“有效氢”表示,“有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
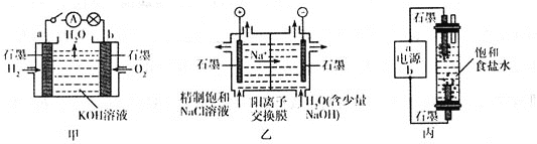
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_____________(填“正”或“负”)极,该装置内发生反应的化学方程式为___________________________________________________________________。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL 盐酸于试管中,试回答下列问题:

(1)写出试管内反应的离子方程式_____________________;
(2)写出生成物MgCl2的电子式__________________;
(3)实验中观察到石灰水中的现象__________,产生上述现象的原因是___________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com